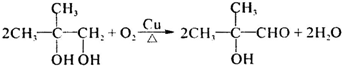
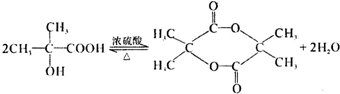
题目内容
20.下列各反应中,生成物总能量比反应物总能量高的是( )| A. | 电解饱和食盐水 | B. | 铁生锈 | C. | 木炭燃烧 | D. | 工业合成氨 |
分析 反应中,生成物总能量比反应物总能量高的反应是吸热反应,根据从常见的吸热反应有:绝大多数的分解反应、以C或CO或氢气为还原剂的氧化还原反应、碱和铵盐的反应等来分析.
解答 解:A、电解饱和食盐水是吸热过程,故A符合;
B、铁生锈过程是缓慢氧化过程,反应中放热,故B不符合;
C、木炭燃烧是放热反应,故C不符合;
D、工业合成氨为化合反应,故为放热反应,故D不符合.
故选A.
点评 本题考查了反应能量的变化判断,掌握常见反应的能量变化是解题关键,题目较简单.

练习册系列答案
相关题目
11.下列说法正确的是( )
| A. | SO2能使溴水褪色,这表现了SO2的漂白性 | |
| B. | 钠钾合金可用于快中子反应堆的热交换剂 | |
| C. | 氨的水溶液能导电,所以氨是强电解质 | |
| D. | 按a、b两种途径制备等量的硝酸镁,消耗的二种酸的物质的量不同 途径a:Mg$→_{△}^{O_{2}}$MgO$\stackrel{稀硝酸}{→}$Mg(NO3)2 途径b:Mg$\stackrel{浓硫酸}{→}$MgSO4$\stackrel{Ba(NO_{3})_{2}溶液}{→}$Mg(NO3)2 |
8.锌银电池在放电时,电池总反应方程式可表示为:Zn+Ag2O+H2O=Zn(OH)2+2Ag.下列有关化学电池的说法正确的是( )
| A. | 该电池又称纽扣电池,是可充电池,适用于大电流连续放电 | |
| B. | 该电池属于碱性电池,放电过程中,锌失去电子生成锌离子,向负极移动 | |
| C. | 该电池在放电过程中,正极的pH变大 | |
| D. | 该电池的负极反应式:Zn-2e-=Zn2+ |
15.若阿伏加德罗常数记为NA,则12g 14C(原子核内有6个质子8个中子)含有14C原子数(已知一个14C的质量比一个12C的质量大)( )
| A. | 等于NA | B. | 小于NA | C. | 大于NA | D. | 等于NA |
5.下列说法正确的是( )
| A. | 分子晶体中,可能不存在共价键,但一定存在分子间作用力 | |
| B. | 两种元素组成的分子中一定只有极性键 | |
| C. | 只含共价键的物质,一定是共价化合物 | |
| D. | 氧化还原反应中,一种元素化合价上升,一定有另一种元素化合价下降 |
9.利用下列实验装置能完成相应实验的是( )
| A. | 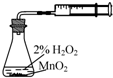 装置可测定化学反应速率 | |
| B. | 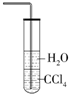 装置可用于吸收氨气,并防止倒吸 | |
| C. |  装置量取8.5 mL的稀硫酸 | |
| D. |  装置可制备氢氧化亚铁并观察其颜色 |
18.设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5NA | |
| B. | 0.1 mol CnH2n+2中含有的共用电子对数为0.3nNA | |
| C. | 46g NO2和N2O4以任意比混合,所得混合气体中氧原子数2NA | |
| D. | 电解精炼铜时,阳极质量减少64g,则阴极得到的电子数为2NA |
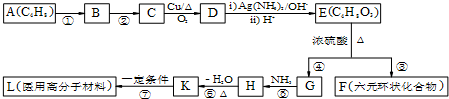
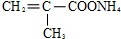 .
.