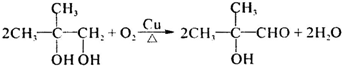
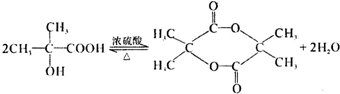
题目内容
7.现有常温下的四种溶液(如表):| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | 分别加水稀释10倍,四种溶液的pH:①>②>④>③ | |
| B. | 将③、④分别稀释到pH=5,由水电离出氢离子的浓度均减小100倍 | |
| C. | 在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 | |
| D. | 将①、④两种溶液等体积混合,所得溶液中:c(OH-):c(H+)>1 |
分析 A.加水促进弱电解质的电离;
B.醋酸为弱电解质,将①、④两种溶液分别稀释到PH=5,依据水溶液中的离子积常数分析判断;
C.在氨水中加入氯化铵,抑制氨水的电离,在氢氧化钠溶液中加入氯化铵,生成一水合氨;
D.氨水平衡状态下电离出的氢氧根离子浓度和盐酸溶液中的氢离子浓度相等,等体积混合反应,结合氨水是弱电解质有电离出氢氧根离子分析判断;
解答 解:A.氨水加水稀释时,电离程度增大,进一步电离出OH-离子,醋酸加水稀释电离程度增大,进一步电离出氢离子,则分别加水稀释10倍后四种溶液的pH大小顺序为①>②>④>③,故A正确;
B.醋酸为弱电解质,将③、④两种溶液分别稀释有PH=3到PH=5,依据[H+][OH-]=10-14,所以由水电离出氢离子的浓度均增大100倍,故B错误;
C.在氨水中加入氯化铵,抑制氨水的电离,溶液pH减小,在氢氧化钠溶液中中加入氯化铵,生成一水合氨,溶液pH减小,故C错误;
D.PH=11的氨水和PH=3的盐酸溶液,溶液中氢氧根离子和氢离子浓度相同,等体积混合,由于氨水是弱电解质存在电离平衡,混合后氢离子全部反应反应,氨水又电离出氢氧根离子,所以所得溶液中:c(OH-):c(H+)>1,故D正确;
故选AD.
点评 本题考查酸碱混合的定性判断,题目难度中等,本题注意把握弱电解质的电离特征,注意四种溶液离子浓度相等时,弱电解质浓度大,等体积时,弱电解质的物质的量多.稀释时促进弱电解质的电离.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
17.能用键能大小解释的事实是( )
| A. | 硝酸比磷酸易挥发 | |
| B. | 金刚石的熔点比晶体硅高 | |
| C. | 惰性气体一般很难发生化学反应 | |
| D. | 通常情况下单质溴呈液态、碘呈固态 |
18.白皮杉醇具有抗炎、抗菌、抗氧化、抗白血病、提高免疫调节功能等功效,其人工合成过程涉及了如下转化: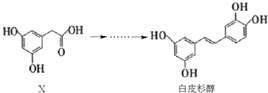
下列说法正确的是( )

下列说法正确的是( )
| A. | X的分子式为C8H10O4 | |
| B. | 化合物X、白皮杉醇均可与Na2CO3溶液反应并放出气体 | |
| C. | 白皮杉醇与浓溴水反应时,最多可消耗6 mol Br2 | |
| D. | 在一定条件下,白皮杉醇可发生加成、取代、氧化和聚合反应 |
15.若阿伏加德罗常数记为NA,则12g 14C(原子核内有6个质子8个中子)含有14C原子数(已知一个14C的质量比一个12C的质量大)( )
| A. | 等于NA | B. | 小于NA | C. | 大于NA | D. | 等于NA |
2.下列事实不能用勒夏特列原理解释的是( )
| A. | 打开啤酒瓶盖,产生大量气泡 | |
| B. | 氢气与碘蒸气的平衡体系,加压后颜色加深 | |
| C. | 制取乙酸丁酯时,加入过量的乙酸 | |
| D. | 配制氯化铁溶液时,加入少量盐酸 |
19.下列实验不能达到预期目的是( )
| 序号 | 实验操作 | 实验目的 |
| A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
| B | MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
| C | 测定Na2CO3、Na2SO4两溶液的pH | 比较碳、硫的非金属性强弱 |
| D | 用同一电路测定等浓度的盐酸、醋酸两溶液的导电性 | 比较盐酸、醋酸的酸性强弱 |
| A. | A | B. | B | C. | C | D. | D |
16.防治禽流感的重要措施之一是迅速、高效灭绝病毒.下列物质不能作为疫区杀菌消毒剂的是( )
| A. | 甲醛 | B. | 生石灰 | C. | 过氧化氢 | D. | 次氯酸钠 |
5.近年来,城市雾霾现象频繁.从物质分类来看雾霾属于胶体,它区别于溶液等其它分散系的本质特征是( )
| A. | 胶粒可以导电 | B. | 胶体是混合物 | ||
| C. | 胶体的分散剂为气体 | D. | 胶体粒子大小在1~100nm 之间 |
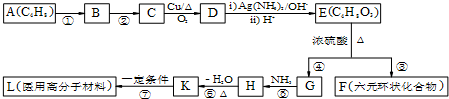
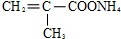 .
.