题目内容
7. 对于2NO2(g)═N2O4(g)△H<0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.则下列说法正确的是( )
对于2NO2(g)═N2O4(g)△H<0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.则下列说法正确的是( )| A. | A、C两点的反应速率:A>C | |
| B. | A、C两点气体的颜色:A深、C浅 | |
| C. | B、C两点的气体的平均分子质量:B<C | |
| D. | 由状态B到状态A,可以用加热方法 |
分析 2NO2(g)?N2O4(g)△H<0,该反应为放热反应,若升高温度,化学平衡向着逆向移动,混合气体中NO2的体积分数增大;如果增大压强,化学平衡向着正向移动,混合气体中NO2的体积分数减小,然后结合图象来分析解答.
解答 解:A.由图象可知,A、C两点都在等温线上,C的压强大,则A、C两点的反应速率:A<C,故A错误;
B.根据平衡常数可知,A、C两点温度相同,C点压强大,则二氧化氮浓度大,因此A、C两点气体的颜色:A浅、C深,故B错误;
C.B、C两点的体积分数相同,所以气体的平均分子质量:B=C,故C错误;
D.升高温度,化学平衡向着逆向移动,NO2的体积分数增大,B点到A点二氧化氮体积分数增大,说明是升高了温度,所以能用加热的方法实现由B点到A点的转变,故D正确;
故选D.
点评 本题考查化学平衡的图象,明确外界条件对化学平衡的影响及图象中纵横坐标的含义,然后利用“定一议二”、“先拐先平”的方法进行解答即可,难度不大.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目
17.工业上真空炼铷的反应方程式为2RbCl2+Mg$\stackrel{熔融}{?}$MgCl2+2Rb↑,对此反应能够进行正确解释的是( )
| A. | 高温下Mg2+得电子的能力比Rb+弱 | |
| B. | MgCl2对热的稳定性比RbCl强 | |
| C. | 在一定条件下,Mg的金属性比Rb强 | |
| D. | 铷的沸点比镁低,及时抽走铷蒸气使平衡向正反应方向移动 |
2.辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2).一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:
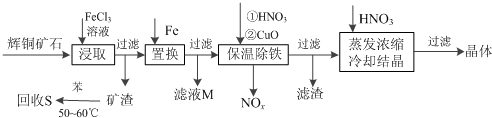
已知:部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表
(1)写出浸取过程中Cu2S溶解成Cu2+的离子方程式Cu2S+4Fe3+=2Cu2++4Fe2++S.
(2)气体NOx 与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为4NOx+(5-2x)O2+2H2O=4HNO3
(3)可向滤液M中加入(或通入)下列D(填字母)物质,得到较多的另一种可循环利用的物质.
A.Fe B.NaClO C.H2O2 D.Cl2
(4)蒸发浓缩时,要用硝酸调节溶液的pH,其作用是调节溶液pH使使铁元素完全转化为氢氧化铁沉淀,抑制铜离子水解.
(5)在除铁阶段,如果pH控制不当会使产量降低.你认为应该采取的补救措施是:将滤渣加入到HNO3中将pH调为3.7-4.7,充分反应后过滤,将滤液与原滤液合并.

已知:部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
(2)气体NOx 与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为4NOx+(5-2x)O2+2H2O=4HNO3
(3)可向滤液M中加入(或通入)下列D(填字母)物质,得到较多的另一种可循环利用的物质.
A.Fe B.NaClO C.H2O2 D.Cl2
(4)蒸发浓缩时,要用硝酸调节溶液的pH,其作用是调节溶液pH使使铁元素完全转化为氢氧化铁沉淀,抑制铜离子水解.
(5)在除铁阶段,如果pH控制不当会使产量降低.你认为应该采取的补救措施是:将滤渣加入到HNO3中将pH调为3.7-4.7,充分反应后过滤,将滤液与原滤液合并.
19.除去Na2CO3固体中少量NaHCO3的最好方法是( )
| A. | 加NaOH溶液 | B. | 加热 | C. | 加稀盐酸 | D. | 加Ca(OH)2溶液 |
16.X、Y、Z、W四种主族元素分属于元素周期表的前三周期,原子序数依次增加,它们原子的最外层电子数之和为15,Y2-和Z2+的电子层结构相同.下列说法正确的是( )
| A. | 氢化物的沸点:Y<W | |
| B. | 简单离子的半径:W>Y>Z>X | |
| C. | W的氧化物对应的水化物是一种强酸 | |
| D. | 与Z同族的下一周期元素的单质不能与N2反应 |
17.下列操作或装置能达到实验目的是( )
| A. |  检验铁粉与水蒸气反应产生的氢气 | |
| B. |  快速制备和收集一定量的氨气 | |
| C. |  分离互溶但沸点相差较大的液体混合物 | |
| D. |  直接蒸发氯化铁溶液获得氯化铁晶体 |


 (R、R′可以是氢原子、烃基或官能团)
(R、R′可以是氢原子、烃基或官能团) .
. .
. .
.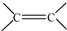 和
和 结构的D的所有同分异构共有7种(不包括顺反异构体),写出其中任意两种的结构简式CH2=CHCH2COOH、CH3CH=CHCOOH、CH2=CHCOOCH3、HCOOCH2CH=CH2、HCOOCH=CHCH3、CH3COOCH=CH2、HCOOC(CH3)=CH2(其中任两种).
结构的D的所有同分异构共有7种(不包括顺反异构体),写出其中任意两种的结构简式CH2=CHCH2COOH、CH3CH=CHCOOH、CH2=CHCOOCH3、HCOOCH2CH=CH2、HCOOCH=CHCH3、CH3COOCH=CH2、HCOOC(CH3)=CH2(其中任两种).