题目内容
18.根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):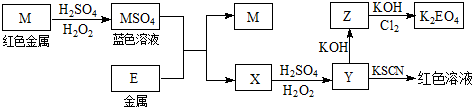
已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ•mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.84kJ•mol-1
(1)写出M溶于稀H2SO4和H2O2混合液的热化学方程式:Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l)△H=-319.68kJ.mol-1.
(2)某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色.写出与上述变化过程中产生氧化剂这一步相关的离子方程式:4Fe2++O2+4H+═4Fe3++2H2O.
(3)写出Cl2将Z氧化为K2EO4的化学方程式:10KOH+3Cl2+2Fe(OH)3═2K2FeO4+6KCl+8H2O.
(4)用Y溶液可测定某硫酸厂排放的尾气中SO2的体积分数.实验操作如下:
①取2.8L(已折算成标准状况)气体样品,将280mL通入到盛足量的Y溶液的锥形瓶中.
②待完全反应后,用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL.已知反应:
2Fe3++SO2+2H2O═2Fe2++SO42-+4H+
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
则该厂排放的尾气中SO2的体积分数为12.00%.
分析 由蓝色溶液可知,M为Cu,红色溶液可知,Y中含Fe3+,则金属E为Fe,X为FeSO4,Z为Fe(OH)3,
(1)①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ•mol-1
②2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.84kJ•mol-1,结合盖斯定律可知①+②×$\frac{1}{2}$+③得到Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l);
(2)亚铁离子被氧化,生成的铁离子与碘离子可发生氧化还原反应;
(3)发生氧化还原反应生成高铁酸钾;
(4)由2Fe3++SO2+2H2O═2Fe2++SO42-+4H+、Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,K2Cr2O7~3SO2,以此计算.
解答 解:由蓝色溶液可知,M为Cu,红色溶液可知,Y中含Fe3+,则金属E为Fe,X为FeSO4,Z为Fe(OH)3,
(1)①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ•mol-1
②2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.84kJ•mol-1,结合盖斯定律可知①+②×$\frac{1}{2}$+③得到Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l),
则M溶于稀H2SO4和H2O2混合液的热化学方程式为Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l)△H=-319.68kJ.mol-1,
故答案为:Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l)△H=-319.68kJ.mol-1;
(2)亚铁离子被氧化,生成的铁离子与碘离子可发生氧化还原反应,产生氧化剂这一步相关的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,
故答案为:4Fe2++O2+4H+═4Fe3++2H2O;
(3)发生氧化还原反应生成高铁酸钾,化学方程式为10KOH+3Cl2+2Fe(OH)3═2K2FeO4+6KCl+8H2O,故答案为:10KOH+3Cl2+2Fe(OH)3═2K2FeO4+6KCl+8H2O;
(4)由2Fe3++SO2+2H2O═2Fe2++SO42-+4H+、Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,K2Cr2O7~3SO2,则该厂排放的尾气中SO2的体积分数为
$\frac{0.025L×0.02mol/L×3×\frac{2800mL}{280}×22.4L/mol}{2.8L}$×100%=12.00%,故答案为:12.00%.
点评 本题考查无机物的推断及计算等,为高频考点,把握转化中红色溶液、蓝色溶液为推断的突破口,侧重分析与推断、应用能力的综合考查,题目难度不大.

 单元期中期末卷系列答案
单元期中期末卷系列答案| A. | 上述反应为化合反应 | |
| B. | “通路”是胶体对光产生的丁达尔现象 | |
| C. | 上述反应为氧化还原反应 | |
| D. | 产生的臭氧有毒,会严重影响人体健康 |
| A. | 托盘天平 | B. | 容量瓶 | C. | 玻璃棒 | D. | 胶头滴管 |
| A. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+28.7 kJ/mol | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-28.7 kJ/mol | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.4 kJ/mol | |
| D. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ/mol |
| A. | 24g Mg变为Mg2+时失去的电子数为2NA | |
| B. | 含有NA个氦原子的氦气在标准状况下的体积约为22.4L | |
| C. | 常温常压下,22 g氧气和26 g臭氧所含氧原子总数为3 NA | |
| D. | 18 g重水(D2O)所含电子数为10NA |
| A. | 食盐和醋都是常用的食品添加剂 | |
| B. | 钙、铁、碘都是人体内必需的微量元素 | |
| C. | ClO2、O3等均可用于饮用水消毒 | |
| D. | 静脉滴注NaHCO3溶液可治疗水杨酸中毒反应 |
 对于2NO2(g)═N2O4(g)△H<0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.则下列说法正确的是( )
对于2NO2(g)═N2O4(g)△H<0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.则下列说法正确的是( )| A. | A、C两点的反应速率:A>C | |
| B. | A、C两点气体的颜色:A深、C浅 | |
| C. | B、C两点的气体的平均分子质量:B<C | |
| D. | 由状态B到状态A,可以用加热方法 |
 某位同学在查阅资料时发现含氮化合物有以下性质:
某位同学在查阅资料时发现含氮化合物有以下性质:
 .
.