题目内容
16.X、Y、Z、W四种主族元素分属于元素周期表的前三周期,原子序数依次增加,它们原子的最外层电子数之和为15,Y2-和Z2+的电子层结构相同.下列说法正确的是( )| A. | 氢化物的沸点:Y<W | |
| B. | 简单离子的半径:W>Y>Z>X | |
| C. | W的氧化物对应的水化物是一种强酸 | |
| D. | 与Z同族的下一周期元素的单质不能与N2反应 |
分析 X、Y、Z、W四种主族元素分属于元素周期表的前三周期,原子序数依次增加,Y2-和Z2+的电子层结构相同,则Y位于第二周期,Z位于第三周期,所以Y为O元素,Z为Mg元素;四种原子的最外层电子数之和为15,则X和W的最外层电子数之和为15-6-2=7,则X、W为H、S或Be、P或B、Si或C、Al,据此结合元素的性质分析.
解答 解:X、Y、Z、W四种主族元素分属于元素周期表的前三周期,原子序数依次增加,Y2-和Z2+的电子层结构相同,则Y位于第二周期,Z位于第三周期,所以Y为O元素,Z为Mg元素;四种原子的最外层电子数之和为15,则X和W的最外层电子数之和为15-6-2=7,则X、W为H、S或Be、P或B、Si或C、Al,
A.Y为O元素,若W为S元素,则氢化物的沸点:Y>W,故A错误;
B.B、C、Si、P不能形成简单离子,所以X是H元素,所以简单离子的半径:W>Y>Z>X,故B正确;
C.W为Al或Si或P或S,其氧化物对应的水化物不一定是一种强酸,故C错误;
D.Z为Mg,Mg能与氮气反应,所以Mg同族的下一周期元素的单质能与N2反应,故D错误.
故选B.
点评 本题考查结构性质位置关系应用,题目难度不大,侧重对核外电子排布、元素周期律的考查,根据已知条件推断出具体的元素是解题关键,注意对元素周期律的理解掌握.

练习册系列答案
相关题目
6.实验室用已知密度的37%的盐酸配制15%的盐酸,除量筒、烧杯外还需使用下列仪器中的( )
| A. | 托盘天平 | B. | 容量瓶 | C. | 玻璃棒 | D. | 胶头滴管 |
7. 对于2NO2(g)═N2O4(g)△H<0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.则下列说法正确的是( )
对于2NO2(g)═N2O4(g)△H<0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.则下列说法正确的是( )
 对于2NO2(g)═N2O4(g)△H<0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.则下列说法正确的是( )
对于2NO2(g)═N2O4(g)△H<0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.则下列说法正确的是( )| A. | A、C两点的反应速率:A>C | |
| B. | A、C两点气体的颜色:A深、C浅 | |
| C. | B、C两点的气体的平均分子质量:B<C | |
| D. | 由状态B到状态A,可以用加热方法 |
4.松油醇具有紫丁香味,其酯类常用于香精调制.如图为松油醇的结构,以下关于它的说法正确的是( )

| A. | 分子式为C10H19O | |
| B. | 同分异构体可能属于醛类、酮类或酚类 | |
| C. | 能发生取代、氧化、还原反应 | |
| D. | 与氢气加成后的产物有4种一氯化物 |
6.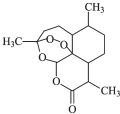 中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
 中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
中国女科学家屠呦呦因为发现青蒿素获颁诺贝尔医学奖.如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )| A. | 青蒿素分子式为C15H22O5 | |
| B. | 青蒿素含有“-O-O-”键具有较强的氧化性 | |
| C. | 青蒿素易发生加成反应和氧化反应 | |
| D. | 青蒿素在碱性条件下易发生水解反应 |
 是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如所示:
是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如所示:
 $→_{△}^{H_{2}O/H+}$
$→_{△}^{H_{2}O/H+}$
 .
. $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +H2O.
+H2O. ,与D互为同分异构体且含有碳碳双键的苯的二取代物有6种,其中核磁共振氢谱为5组峰,且峰面积比为2:1:2:2:1的结构简式是
,与D互为同分异构体且含有碳碳双键的苯的二取代物有6种,其中核磁共振氢谱为5组峰,且峰面积比为2:1:2:2:1的结构简式是 (任写一种).
(任写一种). )的
)的
 .
. 氮及其化合物与人类生产、生活息息相关.回答下列问题:
氮及其化合物与人类生产、生活息息相关.回答下列问题: