题目内容
2.辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2).一种以辉铜矿石为原料制备硝酸铜的工艺流程如下: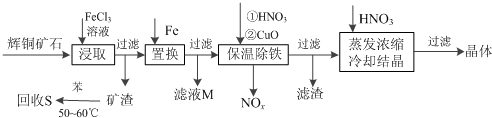
已知:部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
(2)气体NOx 与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为4NOx+(5-2x)O2+2H2O=4HNO3
(3)可向滤液M中加入(或通入)下列D(填字母)物质,得到较多的另一种可循环利用的物质.
A.Fe B.NaClO C.H2O2 D.Cl2
(4)蒸发浓缩时,要用硝酸调节溶液的pH,其作用是调节溶液pH使使铁元素完全转化为氢氧化铁沉淀,抑制铜离子水解.
(5)在除铁阶段,如果pH控制不当会使产量降低.你认为应该采取的补救措施是:将滤渣加入到HNO3中将pH调为3.7-4.7,充分反应后过滤,将滤液与原滤液合并.
分析 辉铜矿加入氯化铁溶液溶解浸取过滤,得到矿渣加入苯水浴加热回收硫单质;加入在滤液中加入铁还原铁离子和铜离子过滤,滤液M中加入氯气氧化反应生成氯化铁循环使用,保温除铁加入稀硝酸溶液和氧化铜反应,调节溶液PH除去杂质离子,过滤得到滤液为硫酸亚铁溶液,在稀硝酸溶液中蒸发浓缩,冷却结晶过滤洗涤得到晶体;
(1)铁离子做氧化剂被还原为亚铁离子,Cu2S被氧化,生成铜离子和硫单质.
(2)由流程可知,硝酸可循环应用;
(3)向滤液M中通入Cl2将FeCl2氧化为FeCl3,可以循环使用;
(4)Fe3++3H2O?Fe(OH)3+3H+,加入CuO使水解平衡正向进行,调节溶液的PH使铁元素完全转化为氢氧化铁沉淀,加热过程中Cu2+会水解,加入硝酸抑制Cu2+的水解,不引入新的杂质.
解答 解:辉铜矿加入氯化铁溶液溶解浸取过滤,得到矿渣加入苯水浴加热回收硫单质;加入在滤液中加入铁还原铁离子和铜离子过滤,滤液M中加入氯气氧化反应生成氯化铁循环使用,保温除铁加入稀硝酸溶液和氧化铜反应,调节溶液PH除去杂质离子,过滤得到滤液为硫酸亚铁溶液,在稀硝酸溶液中蒸发浓缩,冷却结晶过滤洗涤得到晶体;
(1)铁离子做氧化剂,Cu2S被氧化,离子方程式为:Cu2S+4Fe3+=2Cu2++4Fe2++S,
故答案为:Cu2S+4Fe3+=2Cu2++4Fe2++S;
(2)NOx 与氧气混合后通入水中能生成流程中可循环利用的一种物质硝酸,该反应的化学方程式为4NOx+(5-2x)O2+2H2O=4HNO3,
故答案为:4NOx+(5-2x)O2+2H2O=4HNO3;
(3)向滤液M中加H2O2或通入Cl2将FeCl2氧化为FeCl3,可以循环使用,故答案为:CD;
(4)Fe3++3H2O?Fe(OH)3+3H+,加入CuO使水解平衡正向进行,调节溶液的pH使铁元素完全转化为氢氧化铁沉淀,加热过程中Cu2+会水解,加入硝酸抑制Cu2+的水解,不引入新的杂质,
故答案为:调节溶液pH使使铁元素完全转化为氢氧化铁沉淀,抑制铜离子水解;
(5)在除铁阶段,如果pH控制不当会使产量降低.你认为应该采取的补救措施是:将滤渣加入到HNO3中将pH调为3.7-4.7,只有铁离子转化为沉淀,充分反应后过滤,将滤液与原滤液合并,故答案为:3.7-4.7.
点评 本题考查混合物分离提纯的综合应用及物质制备实验,为高频考点,把握流程中的反应、混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度中等.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案| A. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+28.7 kJ/mol | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-28.7 kJ/mol | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.4 kJ/mol | |
| D. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ/mol |
| A. | 食盐和醋都是常用的食品添加剂 | |
| B. | 钙、铁、碘都是人体内必需的微量元素 | |
| C. | ClO2、O3等均可用于饮用水消毒 | |
| D. | 静脉滴注NaHCO3溶液可治疗水杨酸中毒反应 |
| A. | 可用纤维素的水解产物制取乙醇 | |
| B. | 己烷(C6H14)有四种同分异构体 | |
| C. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | |
| D. | 糖类、油脂和蛋白质均可发生水解反应 |
 对于2NO2(g)═N2O4(g)△H<0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.则下列说法正确的是( )
对于2NO2(g)═N2O4(g)△H<0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.则下列说法正确的是( )| A. | A、C两点的反应速率:A>C | |
| B. | A、C两点气体的颜色:A深、C浅 | |
| C. | B、C两点的气体的平均分子质量:B<C | |
| D. | 由状态B到状态A,可以用加热方法 |

 .
.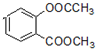 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+ +H2O.
+H2O.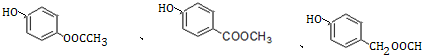 .
.
 H2O和CS2分子中的原子都达到稳定结构.
H2O和CS2分子中的原子都达到稳定结构.