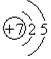题目内容
15.用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成.(1)Al的原子结构示意图为
 ;Al与NaOH溶液反应的离子方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
;Al与NaOH溶液反应的离子方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.(2)30Si的原子的中子数为16;
(3)Al3+与Yn-的电子数相同,Y所在族的各元素的氢化物的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是HCl.
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是CO2.
(5)经处理后的熔渣36.0g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0g固体;滤液中加入过量NaOH溶液,分离得到21.4g固体;则此熔渣中Al2O3的质量分数为25%.
分析 (1)Al的质子数为13,原子结构中存在3个电子层,最外层电子数为3,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气;
(2)根据质量数=质子数+中子数,计算中子数;根据晶体的性质和成键方式判断晶体的类型,SiO2的晶体类型为原子晶体;
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则Y是第VIIA元素,氢化物的沸点随着相对分子质量的增大而增大,但含有氢键的氢化物沸点反常;
(4)由药皮的成分和物质的性质进行推断产生的使金属不被氧化的气体成分为二氧化碳;
(5)36.0g(仅含Fe2O3、Al2O3、SiO2)加入足量稀盐酸,二氧化硅不和盐酸反应,所以分离得到11.0g的固体是二氧化硅,滤液中加入过量NaOH溶液,分离得到21.4g固体是氢氧化铁,根据铁原子守恒计算氧化铁的质量,剩余的质量就是氧化铝,再根据质量分数公式进行计算.
解答 解:(1)Al的质子数为13,原子结构中存在3个电子层,最外层电子数为3,其原子结构示意图为 ,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
故答案为: ;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)在原子符合的表达式中左上角表示质量数,左下角表示质子数,根据质量数=质子数+中子数可计算出30Si的原子的中子数为:30-14=16,故答案为:16;
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则Y是第VIIA元素,氢化物的沸点随着相对分子质量的增大而增大,但HF中含有氢键导致HF的沸点大于HCl,所以该族氢化物中沸点最低的是HCl,
故答案为:HCl;
(4)由药皮的成分大理石、水泥、硅铁可知,在高温下只有大理石才分解产生CO2,因此气体只能是CO2气体,
故答案为:CO2;
(5)36.0g(仅含Fe2O3、Al2O3、SiO2)加入足量稀盐酸,二氧化硅不和盐酸反应,所以分离得到11.0g的固体是二氧化硅;
当滤液中加入过量NaOH溶液时AlCl3生成NaAlO2,FeCl3生成Fe(OH)3沉淀,所以分离得到21.4g固体是氢氧化铁,根据2Fe(OH)3→Fe2O3,氧化铁的质量=$\frac{160×21.4}{214}$g=16g,氧化铝的质量=(36.0-11.0-16)g=9g,氧化铝的质量分数=$\frac{9g}{36g}$×100%=25%,
故答案为:25%.
点评 本题考查混合物分离提纯及原子结构,为高频考点,把握物质的性质、混合物分离方法选择、原子构成等为解答的关键,侧重分析与应用能力的考查,题目难度中等.

(1)已知O2(g)?O2(aq)△H=nkJ•mol-1,Na2SO3溶液与O2(g)反应的热化学方程式为2Na2SO3(aq)+O2(g)=2Na2SO4(aq)△H=(m+n)kJ•mol-1
(2)291.5K时,1.0L溶液中Na2SO3初始量分别为4、6、8、12mmol,溶解氧浓度初始值为9.60mg•L-1,每5s记录溶解氧浓度,实验结果如图.当Na2SO3的初始量为12mmol,经过20s溶解氧浓度降为6.40mg•L-1,则0-20s内Na2SO3的平均反应速率为1.00×10-5mol•L-1•s-1
(3)为确定贫氧区速率方程v=kca(SO32-)•cb(O2)中a,b的值(取整数),分析实验数据.
| c(Na2SO3)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
| v×106 | 10.2 | 24.4 | 44.7 | 103.6 |
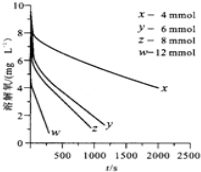
②当溶解氧浓度小于4.0mg•L-1时,图中曲线皆为直线,则b=0,
(4)两个阶段不同温度的速率常数(k)之比如表.
| 反应阶段 | 速率方程 | $\frac{k(297.0K)}{k(291.5K)}$ |
| 富氧区 | v=kc(SO32-)•c(O2) | 1.47 |
| 贫氧区 | v=kca(SO32-)•cb(O2) | 2.59 |
(5)结合图表分析,Na2SO3初始量不同时,划分富氧区与贫氧区的溶解氧浓度是否相同,为什么?.
(6)一定温度下,化学反应速率仅与决速步的反应物浓度有关.Na2SO3氧化反应历程涉及的
①SO32-+O2→SO5-
②SO5-+SO32-→SO52-+SO3-
③SO32-+SO32-→SO3-+SO32-
④SO32-+O2→SO5-
⑤SO52-+SO32-→2SO42-
富氧区与和贫氧区的决速步分别是①、③(填序号)

| 选项 | 操作1 | 操作2 | 操作3 | 操作4 |
| A | 溶解 | 结晶 | 蒸发 | 过滤 |
| B | 蒸发 | 过滤 | 冷却 | 过滤 |
| C | 蒸发 | 结晶 | 结晶 | 蒸发 |
| D | 过滤 | 结晶 | 冷却 | 结晶 |
| A. | A | B. | B | C. | C | D. | D |
(1)SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO
(2)Si(粗)+2Cl2$\frac{\underline{\;加热\;}}{\;}$SiCl4
(3)SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$ Si (纯)+4HCl
对上述三个反应叙述中,不正确的是( )
| A. | (1)(3)为置换反应 | B. | (1)(2)(3)均为氧化还原反应 | ||
| C. | (2)为化合反应 | D. | 反应物中硅元素均被还原 |
| A. | 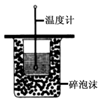 进行中和热的测定 | |
| B. | 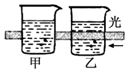 运用该实验可区分胶体和溶液 | |
| C. | 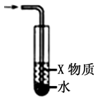 X若为苯,可用于吸收NH3或HCl,并防止倒吸 | |
| D. |  验证AgCl溶解度大于Ag2S |
| A. | NH4Cl的电子式: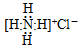 | |
| B. | 对硝基甲苯: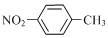 | |
| C. | 碳酸的电离方程式:H2CO3?2H++CO${\;}_{3}^{2-}$ | |
| D. | 硫离子的结构示意图: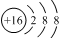 |