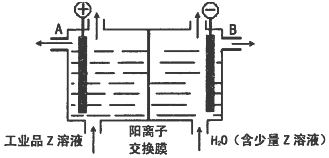
题目内容
3.制备硅单质时,主要化学反应如下:(1)SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO
(2)Si(粗)+2Cl2$\frac{\underline{\;加热\;}}{\;}$SiCl4
(3)SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$ Si (纯)+4HCl
对上述三个反应叙述中,不正确的是( )
| A. | (1)(3)为置换反应 | B. | (1)(2)(3)均为氧化还原反应 | ||
| C. | (2)为化合反应 | D. | 反应物中硅元素均被还原 |
分析 A.单质与化合价反应生成单质与化合物的反应,为置换反应;
B.上述三个反应中均有元素的化合价升降;
C.两种或两种以上的物质反应生成一种物质,为化合反应;
D.(1)(3)中Si元素的化合价降低,(2)中Si元素的化合价升高.
解答 解:A.单质与化合价反应生成单质与化合物的反应,为置换反应,显然(1)(3)为置换反应,故A正确;
B.上述三个反应中均有元素的化合价升降,则均属于氧化还原反应,故B正确;
C.两种或两种以上的物质反应生成一种物质,为化合反应,显然(2)为化合反应,故C正确;
D.(1)(3)中Si元素的化合价降低被还原,(2)中Si元素的化合价升高被氧化,故D错误;
故选D.
点评 本题考查氧化还原反应,明确反应中元素的化合价变化是解答本题的关键,注意反应的分类及基本反应类型,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.生物硝化法处理含NH4+的废水的原理如图所示(不考虑其他物质影响),下列说法不正确的是( )

| A. | 可用NaOH和湿润的红色的石蕊试纸检验NH4+ | |
| B. | 该方法会导致水体pH下降 | |
| C. | 该方法中O2做氧化剂,微生物做还原剂 | |
| D. | 处理后的废水需进一步处理才能排放 |
11.某同学为配置含有X,SO42-,Mg2+,NO3-四种离子的无色溶液,要使四种离子的物质的量浓度之比为1:2:1:1,则X应该是:( )
| A. | Fe3+ | B. | Al3+ | C. | NH4+ | D. | Cl- |
18.工业上用铝土矿(主要成分为Al203,含Fe2O3等杂质)为原料冶炼铝的工艺流程如图:对上述流程中的判断正确的是( )
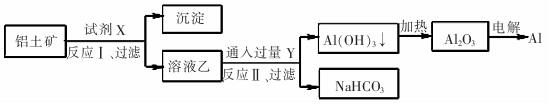

| A. | 试剂X为稀硫酸 | |
| B. | 反应Ⅱ中生成Al(OH)3的反应为:CO2+AlO2-+2H20=Al(OH)3↓+HCO3一 | |
| C. | 结合质子( H+)的能力由强到弱的顺序是Al02->CO32->OH- | |
| D. | Al2O3熔点很高,工业上还可采用电解熔融AICl3冶炼Al |
8.常温下,下列溶液中一定能大量共存的离子组是( )
| A. | 澄清透明的溶液中:NH4+、Cu2+、SO42-、Cl- | |
| B. | 含有大量Fe2+的溶液中:K+、Mg2+、C1O-、SO42- | |
| C. | 加入金属镁能产生H2的溶液中:Na+、Fe2+、SO42-、NO3- | |
| D. | 水电离产生的c(OH-)=l×10-12mol/L的溶液中:Al3+、SO42-、NO3-、Cl- |


 )的废水可以通过构成微生物电池除去,其原理如图5所示.
)的废水可以通过构成微生物电池除去,其原理如图5所示.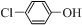 +2e-+H+═
+2e-+H+═ -OH+Cl-.
-OH+Cl-. ;Al与NaOH溶液反应的离子方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
;Al与NaOH溶液反应的离子方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.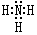 ;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.
;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.