题目内容
10.如图所示的实验,能达到实验目的或说法正确的是( )| A. | 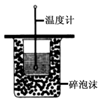 进行中和热的测定 | |
| B. | 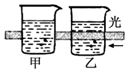 运用该实验可区分胶体和溶液 | |
| C. | 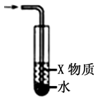 X若为苯,可用于吸收NH3或HCl,并防止倒吸 | |
| D. |  验证AgCl溶解度大于Ag2S |
分析 A.缺少环形玻璃搅拌器;
B.胶体具有丁达尔效应;
C.气体与水直接接触,不能起到防倒吸的作用;
D.硝酸银过量,不能验证AgCl溶解度大于Ag2S.
解答 解:A.测定中和热时,应用环形玻璃搅拌器搅拌,使之充分反应,故A错误;
B.胶体具有丁达尔效应,可形成光路,而溶液不具有此性质,可鉴别,故B正确;
C.气体与水直接接触,不能起到防倒吸的作用,应用四氯化碳,故C错误;
D.硝酸银过量,不能验证AgCl溶解度大于Ag2S,应用少量硝酸银,故D错误.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握实验原理及实验装置的作用为解答的关键,明确实验基本操作和物质的性质即可解答,注意实验的评价性和操作性分析,题目难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
1.某有机化合物结构简式如图,下列有关它的性质的叙述中,正确的是( )


| A. | 有弱酸性,与Na2CO3、NaHCO3溶液均能反应 | |
| B. | 在一定条件下,1 mol该物质最多能与3 mol NaOH完全反应 | |
| C. | 在一定条件下,该物质可以发生取代、加成、水解、消去反应 | |
| D. | 该有机物分子中所有碳原子可能共平面 |
18.工业上用铝土矿(主要成分为Al203,含Fe2O3等杂质)为原料冶炼铝的工艺流程如图:对上述流程中的判断正确的是( )
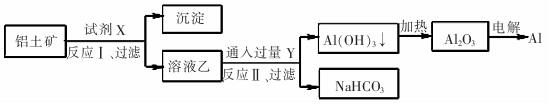

| A. | 试剂X为稀硫酸 | |
| B. | 反应Ⅱ中生成Al(OH)3的反应为:CO2+AlO2-+2H20=Al(OH)3↓+HCO3一 | |
| C. | 结合质子( H+)的能力由强到弱的顺序是Al02->CO32->OH- | |
| D. | Al2O3熔点很高,工业上还可采用电解熔融AICl3冶炼Al |
20. 四种主族元素的性质或结构信息如下:
四种主族元素的性质或结构信息如下:
(1)M的原子结构示意图是 ;上述元素最高价氧化物对应的水化物碱性最强的是(写分子式)Mg(OH)2(元素用元素符号表示,下同!).
;上述元素最高价氧化物对应的水化物碱性最强的是(写分子式)Mg(OH)2(元素用元素符号表示,下同!).
(2)Y单质溶于热浓的硫酸产生的气体的化学式为SO2.
(3)能体现Z单质比Y单质活泼性强的一个化学方程式:S2-+Br2=S+2Br-.
(4)常温下,不能与X的单质持续发生反应的是(填选项序号)bce.
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(5)铁元素与Z元素形成化合物FeZ3,FeZ3溶液按如图所示进行试验.装置通电后,连接电源正极(填“正极”或“负极”)碳棒边的煤油颜色将变深,另一碳棒附近溶液将出现的现象是溶液逐渐变成浅绿色.
 四种主族元素的性质或结构信息如下:
四种主族元素的性质或结构信息如下:| 元素编号 | 相关信息 |
| X | 地壳中含量最大的金属元素;元素最高价为+3价. |
| Y | 原子最外层电子数是电子层数的2倍,最外层电子数是X最外层电子数的2倍. |
| Z | 同周期主族元素中原子半径最小,常温下单质呈液态. |
| M | 能从海水中提取的金属元素,单质可在氮气或二氧化碳中燃烧. |
 ;上述元素最高价氧化物对应的水化物碱性最强的是(写分子式)Mg(OH)2(元素用元素符号表示,下同!).
;上述元素最高价氧化物对应的水化物碱性最强的是(写分子式)Mg(OH)2(元素用元素符号表示,下同!).(2)Y单质溶于热浓的硫酸产生的气体的化学式为SO2.
(3)能体现Z单质比Y单质活泼性强的一个化学方程式:S2-+Br2=S+2Br-.
(4)常温下,不能与X的单质持续发生反应的是(填选项序号)bce.
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(5)铁元素与Z元素形成化合物FeZ3,FeZ3溶液按如图所示进行试验.装置通电后,连接电源正极(填“正极”或“负极”)碳棒边的煤油颜色将变深,另一碳棒附近溶液将出现的现象是溶液逐渐变成浅绿色.
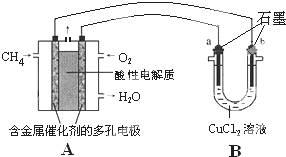 (3)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图.
(3)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图. 图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物,它们的焰色反应均为黄色.请填写下列空白:
图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物,它们的焰色反应均为黄色.请填写下列空白: ;Al与NaOH溶液反应的离子方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
;Al与NaOH溶液反应的离子方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑. 酸碱中和在化工生产中有着重要应用.
酸碱中和在化工生产中有着重要应用.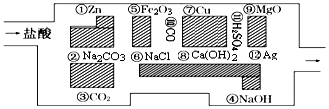
 .其中氧化剂是HCl,还原剂是Zn.
.其中氧化剂是HCl,还原剂是Zn.