题目内容
4.下列有关化学用语表示正确的是( )| A. | NH4Cl的电子式: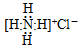 | |
| B. | 对硝基甲苯: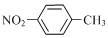 | |
| C. | 碳酸的电离方程式:H2CO3?2H++CO${\;}_{3}^{2-}$ | |
| D. | 硫离子的结构示意图: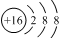 |
分析 A、氯化铵是由氨根离子与氯离子通过离子键结合而成的离子化合物;
B、对硝基苯中的硝基中直接和苯环相连的是N原子;
C、碳酸是二元弱酸,电离分步进行;
D、硫离子的核内有16个质子,核外有18个电子.
解答 解:A、氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ,故A错误;
,故A错误;
B、对硝基苯中的硝基中直接和苯环相连的是N原子,故结构简式为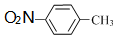 ,故B错误;
,故B错误;
C、碳酸是二元弱酸,电离分步进行,故电离方程式为H2CO3?H++HCO3-,HCO3-?H++CO32-,故C错误;
D、硫离子的核内有16个质子,带16个正电荷,而核外有18个电子,故结构示意图为 ,故D正确.
,故D正确.
故选D.
点评 本题考查了常用的化学用语,难度不大,应注意的是电子式书写时应区分共价化合物和离子化合物.

练习册系列答案
相关题目
14.生物硝化法处理含NH4+的废水的原理如图所示(不考虑其他物质影响),下列说法不正确的是( )

| A. | 可用NaOH和湿润的红色的石蕊试纸检验NH4+ | |
| B. | 该方法会导致水体pH下降 | |
| C. | 该方法中O2做氧化剂,微生物做还原剂 | |
| D. | 处理后的废水需进一步处理才能排放 |
9.下列各组顺序的排列不正确的是( )
| A. | 离子半径:F->Mg2+>Al3+ | B. | 热稳定性:HCl>H2S>AsH3 | ||
| C. | 酸性:H3AlO3<H2CO3<H3PO4 | D. | 水溶性:SO2<H2S<NH3 |
16.为了防治环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以回收高浓度的SO2并得到副产品化肥(NH4)2SO4和NH4HSO4.为测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热至120℃左右,使氨气全部逸出[已知:(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):
(1)测定过程中有关反应的离子方程式为H++OH-=H2O、NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(2)3.7g该样品进行同样实验时,生成的氨气在标准状况下体积为0.84L.
(3)试求算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比.
(4)欲计算该NaOH溶液的物质的量浓度应选择第Ⅲ组数据,并由此计算NaOH溶液的物质的量浓度,写出计算过程.
| 实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
| Ⅰ | 7.4 | 40.00 | 1.68 |
| Ⅱ | 14.8 | 40.00 | 3.36 |
| Ⅲ | 22.2 | 40.00 | 1.12 |
| Ⅳ | 37.0 | 40.00 | 0 |
(2)3.7g该样品进行同样实验时,生成的氨气在标准状况下体积为0.84L.
(3)试求算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比.
(4)欲计算该NaOH溶液的物质的量浓度应选择第Ⅲ组数据,并由此计算NaOH溶液的物质的量浓度,写出计算过程.
 ;Al与NaOH溶液反应的离子方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
;Al与NaOH溶液反应的离子方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
 .其中氧化剂是HCl,还原剂是Zn.
.其中氧化剂是HCl,还原剂是Zn.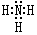 ;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.
;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.