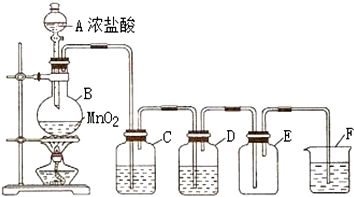
题目内容
10.下列属于人工合成的高分子化合物是( )| A. | 聚氯乙烯 | B. | 淀粉 | C. | 乙酸乙酯 | D. | 苯乙烯 |
分析 A.聚氯乙烯的结构简式为: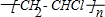 ,是人工合成的高分子化合物;
,是人工合成的高分子化合物;
B.淀粉的分子式是(C6H10O5)n,是天然高分子化合物;
C.乙酸乙酯的结构简式是CH3COOC2H5,不是高分子化合物;
D.苯乙烯的分子式为C8H8,不是高分子化合物.
解答 解:A.聚氯乙烯的结构简式为: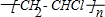 ,是人工合成的高分子化合物,故A正确;
,是人工合成的高分子化合物,故A正确;
B.淀粉的分子式是(C6H10O5)n,是天然高分子化合物,故B错误;
C.乙酸乙酯的结构简式是CH3COOC2H5,不是高分子化合物,故C错误;
D.苯乙烯的分子式为C8H8,不是高分子化合物,故D错误;
故选:A.
点评 本题考查人工高分子化合物以及天然高分子化合物,注意基础知积的积累,题目比较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.某研究性学习小组探究化学反应速率和限度设计并完成下列实验.
请回答下列问题:
(1)实验Ⅰ的目的是探究浓度对化学反率速率的影响,反应的离子方程式是2Al+6H+=2Al3++3H2↑
(2)实验Ⅱ的目的是探究反应物接触面积对反应速率的影响,实验中将块状碳酸钙加入试管中的方法是先将试管横放,用药匙或镊子将药品放在试管口,再将试管慢慢竖起,使药品缓缓的滑到试管底部,防止将试管砸破
(3)实验Ⅲ中观察到的现象是①中颜色浅,②中颜色深,由此得出的结论是降温平衡向放热方向移动,升温平衡向吸热方向移动.
| 实验 | 编号 | 实验温度/℃ | 药品 | |
| Ⅰ | ① | 25 | 铝条 | 盐酸5ml3mol•L-1 |
| ② | 25 | 铝条(规格同上) | 盐酸5ml0.5mol•L-1 | |
| Ⅱ | ① | 25 | 碳酸钙粉末 | 盐酸5ml3mol•L-1 |
| ② | 25 | 块状碳酸钙 | 盐酸5ml3mol•L-1 | |
| Ⅲ | ① | 5 | 二氧化氮与四氧化二氮的混合气体 | |
| ② | 35 | 二氧化氮与四氧化二氮的混合气体 | ||
(1)实验Ⅰ的目的是探究浓度对化学反率速率的影响,反应的离子方程式是2Al+6H+=2Al3++3H2↑
(2)实验Ⅱ的目的是探究反应物接触面积对反应速率的影响,实验中将块状碳酸钙加入试管中的方法是先将试管横放,用药匙或镊子将药品放在试管口,再将试管慢慢竖起,使药品缓缓的滑到试管底部,防止将试管砸破
(3)实验Ⅲ中观察到的现象是①中颜色浅,②中颜色深,由此得出的结论是降温平衡向放热方向移动,升温平衡向吸热方向移动.
1.在短周期元素中,属于非金属元素的有( )
| A. | 9种 | B. | 11种 | C. | 13种 | D. | 15种 |
18.下列说法正确的是( )
| A. | 共价化合物中一定不含离子键 | |
| B. | 离子化合物中一定不含共价键 | |
| C. | 任何化学物质中均存在化学键 | |
| D. | 全部由非金属元素形成的化合物一定是共价化合物 |
5.下列能正确表示Mg的原子结构示意图的是( )
| A. |  | B. |  | C. |  | D. |  |
2.下列有关金属的说法正确的是( )
| A. | 金属原子的核外电子在金属晶体中都是自由电子 | |
| B. | 金属导电的实质是金属阳离子在外电场作用下的定向移动 | |
| C. | 金属原子在化学变化中失去的电子数越多,其还原性越强 | |
| D. | 体心立方晶胞和面心立方晶胞中实际含有的原子个数之比为1:2 |
19.假设反应N2+3H2?2NH3(正反应为放热反应) 的正反应速率是v1,逆反应速率是v2,当升高温度时,v1和v2的变化情况为( )
| A. | 同时增大 | B. | v1减小,v2增大 | C. | 同时减小 | D. | v1增大,v2减小 |
20.25℃时,浓度均为0.1mol•L-1的溶液,其pH如表所示,下列有关说法正确的是( )
| 序号 | ① | ② | ③ | ④ |
| 溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
| pH | 7.0 | 7.0 | 8.1 | 8.4 |
| A. | ①和②中溶质均未水解 | |
| B. | 由③④可得出酸性强弱关系:H2CO3>HF | |
| C. | ③中:c(Na+)+c(H+)=c(Fˉ)+c(OHˉ) | |
| D. | ④中:c(HCO3ˉ)+2c(CO32ˉ)+c(H2CO3)=0.1 mol•L-1 |