题目内容
2.下列有关金属的说法正确的是( )| A. | 金属原子的核外电子在金属晶体中都是自由电子 | |
| B. | 金属导电的实质是金属阳离子在外电场作用下的定向移动 | |
| C. | 金属原子在化学变化中失去的电子数越多,其还原性越强 | |
| D. | 体心立方晶胞和面心立方晶胞中实际含有的原子个数之比为1:2 |
分析 A、金属原子中的最外层电子在晶体中为自由电子,而不是所有的核外电子;
B、金属导电的实质是金属阳离子和自由电子的定向移动,产生电流;
C、金属原子在化学变化中失去的电子数多少和还原性无关;
D、利用均摊法来计算原子的个数.
解答 解:A、因金属的最外层电子受原子核的吸引小,则金属原子中的最外层电子在晶体中为自由电子,故A错误;
B、金属导电的实质是金属阳离子和自由电子定向移动而产生电流的结果,故B错误;
C、金属原子在化学变化中失去电子越容易,其还原性越强,故C错误;
D、体心立方晶胞中原子在顶点和体心,则原子个数为1+8×$\frac{1}{8}$=2,面心立方晶胞中原子在顶点和面心,原子个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,原子的个数之比为2:4=1:2,故D正确.
故选D.
点评 本题考查学生金属晶体中的微粒以及导电的原理知识,学会用均摊法计算,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
相关题目
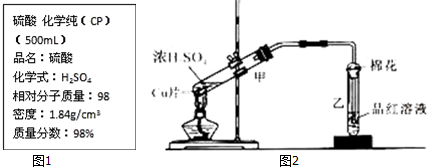
12. 硫酸工业生产应考虑综合经济效益问题.
硫酸工业生产应考虑综合经济效益问题.
(1)若从下列四个城市中选择一处建一座硫酸厂,你认为厂址宜选在C的郊区(填标号).
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为4CuFeS2+13O2=4CuO+2Fe2O3+8SO2;
(3)为了有利于SO2转化SO3,多采用如图所示的装有多层催化剂的接触室(填设备名称)作为反应设备,让气体经历如图所示流程而不是直接进入该设备进行反应的原因是使热量能充分利用.
(4)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是D
A.黄铁矿燃烧前需要粉碎,因为大块的黄铁矿不能在空气中 燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中的二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
(5)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据如表信息,结合工业生产实际,选择最合适的生产条件是400℃、1个大气压.
(6)由吸收塔排出的尾气中SO2的含量超过500umol/L,就要用氨水洗涤烟气脱硫,该反应的化学方程式为2NH3•H2O+SO2=(NH4)2SO3+H2O.
(7)若用浓硫酸吸收SO3可以得到H2SO4•SO3.用1000g 98% 的H2SO4充分吸收SO3后,再进行稀释,可以得到98% 的硫酸的质量是C
A.1.98kg B.2.00kg C.2.22kg D.2.42kg.
 硫酸工业生产应考虑综合经济效益问题.
硫酸工业生产应考虑综合经济效益问题.(1)若从下列四个城市中选择一处建一座硫酸厂,你认为厂址宜选在C的郊区(填标号).
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为4CuFeS2+13O2=4CuO+2Fe2O3+8SO2;
(3)为了有利于SO2转化SO3,多采用如图所示的装有多层催化剂的接触室(填设备名称)作为反应设备,让气体经历如图所示流程而不是直接进入该设备进行反应的原因是使热量能充分利用.
(4)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是D
A.黄铁矿燃烧前需要粉碎,因为大块的黄铁矿不能在空气中 燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中的二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
(5)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据如表信息,结合工业生产实际,选择最合适的生产条件是400℃、1个大气压.
| 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 | |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
(7)若用浓硫酸吸收SO3可以得到H2SO4•SO3.用1000g 98% 的H2SO4充分吸收SO3后,再进行稀释,可以得到98% 的硫酸的质量是C
A.1.98kg B.2.00kg C.2.22kg D.2.42kg.
10.下列属于人工合成的高分子化合物是( )
| A. | 聚氯乙烯 | B. | 淀粉 | C. | 乙酸乙酯 | D. | 苯乙烯 |
7.下列有关化学用语使用及叙述正确的是( )
| A. | 碳酸的电离方程式:H2CO3=2H++CO32- | |
| B. | F-的结构示意图: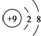 | |
| C. | ${\;}_{55}^{134}$Cs和${\;}_{55}^{137}$Cs形成的单质物理性质相同 | |
| D. | NH3 的电子式: |
14.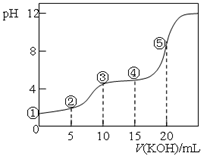 常温下,用0.10mol•L-1 KOH溶液滴定 10.00mL 0.10mol•L-1H2C2O4(二元弱酸)溶液 所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )
常温下,用0.10mol•L-1 KOH溶液滴定 10.00mL 0.10mol•L-1H2C2O4(二元弱酸)溶液 所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )
 常温下,用0.10mol•L-1 KOH溶液滴定 10.00mL 0.10mol•L-1H2C2O4(二元弱酸)溶液 所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )
常温下,用0.10mol•L-1 KOH溶液滴定 10.00mL 0.10mol•L-1H2C2O4(二元弱酸)溶液 所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )| A. | 点①所示溶液中:c(H+)/c(OH-)=1012 | |
| B. | 点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-) | |
| C. | 点③所示溶液中:c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.05mol•L-1 | |
| D. | 点⑤所示溶液中:c(K+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) |
11.某学习小组用如下装置(支撑仪器略去)探究乙醇的催化氧化反应和乙醛的性质.
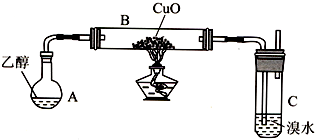
(1)实验开始时,对A进行水浴加热,其目的是产生平稳的乙醇气流.
(2)B中反应方程式为CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O.
(3)若装置C中开始发生倒吸,则采取的应急措施是C(填编号).
A.移去图中的酒精灯B.将C中橡皮塞上的短导气管拔出
C.将B尾端的乳胶管取下D.将A与B之间的乳胶管取下
(4)探究:充分反应后,观察到溴水完全褪色.学习小组通过测定反应前溴水中n(Br2)与反应后溶液中n(Br-)来确定乙醛使溴水褪色的原因.
①假设.请写出假设1的反应类型.
假设1:CH3CHO+Br2→CH2BrCHO+HBr;取代反应
假设2:CH3CHO+Br2→CH3CHBrOBr; 加成反应
假设3:CH3CHO+Br2+H2O→CH3COOH+2HBr. 氧化反应
②结论:若实验测得n(Br2)=0.005mol,n(Br-)=0.01mol,则证明假设3正确.
(5)欲检验乙醇中混有的少量乙醛,甲乙丙三同学设计实验如表:
则上述方案中你认为能正确完成乙醛的检验的是乙(填甲、乙、丙)

(1)实验开始时,对A进行水浴加热,其目的是产生平稳的乙醇气流.
(2)B中反应方程式为CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O.
(3)若装置C中开始发生倒吸,则采取的应急措施是C(填编号).
A.移去图中的酒精灯B.将C中橡皮塞上的短导气管拔出
C.将B尾端的乳胶管取下D.将A与B之间的乳胶管取下
(4)探究:充分反应后,观察到溴水完全褪色.学习小组通过测定反应前溴水中n(Br2)与反应后溶液中n(Br-)来确定乙醛使溴水褪色的原因.
①假设.请写出假设1的反应类型.
假设1:CH3CHO+Br2→CH2BrCHO+HBr;取代反应
假设2:CH3CHO+Br2→CH3CHBrOBr; 加成反应
假设3:CH3CHO+Br2+H2O→CH3COOH+2HBr. 氧化反应
②结论:若实验测得n(Br2)=0.005mol,n(Br-)=0.01mol,则证明假设3正确.
(5)欲检验乙醇中混有的少量乙醛,甲乙丙三同学设计实验如表:
| 试剂、用品 | 预期现象 | |
| 甲 | 酸性高锰酸钾溶液 | 溶液紫红色褪去 |
| 乙 | 溴水 | 溴水褪色 |
| 丙 | 铜丝 酒精灯 | 铜丝由黑色变成光亮的红色 |