题目内容
9.某研究性学习小组探究化学反应速率和限度设计并完成下列实验.| 实验 | 编号 | 实验温度/℃ | 药品 | |
| Ⅰ | ① | 25 | 铝条 | 盐酸5ml3mol•L-1 |
| ② | 25 | 铝条(规格同上) | 盐酸5ml0.5mol•L-1 | |
| Ⅱ | ① | 25 | 碳酸钙粉末 | 盐酸5ml3mol•L-1 |
| ② | 25 | 块状碳酸钙 | 盐酸5ml3mol•L-1 | |
| Ⅲ | ① | 5 | 二氧化氮与四氧化二氮的混合气体 | |
| ② | 35 | 二氧化氮与四氧化二氮的混合气体 | ||
(1)实验Ⅰ的目的是探究浓度对化学反率速率的影响,反应的离子方程式是2Al+6H+=2Al3++3H2↑
(2)实验Ⅱ的目的是探究反应物接触面积对反应速率的影响,实验中将块状碳酸钙加入试管中的方法是先将试管横放,用药匙或镊子将药品放在试管口,再将试管慢慢竖起,使药品缓缓的滑到试管底部,防止将试管砸破
(3)实验Ⅲ中观察到的现象是①中颜色浅,②中颜色深,由此得出的结论是降温平衡向放热方向移动,升温平衡向吸热方向移动.
分析 (1)实验Ⅰ中只有盐酸的浓度不同,温度、反应物的接触面积相同,实验目的是探究浓度对化学反率速率的影响,铝与盐酸反应生成铝离子和氢气;
(2)实验Ⅱ中除接触面积不同外,其他条件都相同,则探究的是接触面积对反应速率的影响,向试管中加入块状固体的操作步骤:先将试管横放,用药匙或镊子将药品放在试管口,再将试管慢慢竖起,使药品缓缓的滑到试管底部,防止将试管砸破;
(3)2NO2(红棕色)?N2O4(无色)△H<0,通过颜色的变化分析温度对平衡的影响.
解答 解:(1)实验Ⅰ中只有盐酸的浓度不同,温度、反应物的接触面积相同,实验目的是探究浓度对化学反率速率的影响,铝与盐酸反应生成铝离子和氢气,离子方程式:2Al+6H+=2Al3++3H2↑,
故答案为:探究浓度对化学反率速率的影响;2Al+6H+=2Al3++3H2↑;
(2)实验Ⅱ中除接触面积不同外,其他条件都相同,则探究的是接触面积对反应速率的影响,向试管中加入块状固体的操作步骤:先将试管横放,用药匙或镊子将药品放在试管口,再将试管慢慢竖起,使药品缓缓的滑到试管底部,防止将试管砸破,
故答案为:探究反应物接触面积对反应速率的影响;先将试管横放,用药匙或镊子将药品放在试管口,再将试管慢慢竖起,使药品缓缓的滑到试管底部,防止将试管砸破;
(3)2NO2(红棕色)?N2O4(无色)△H<0,①中温度低,颜色浅,说明降温平衡向正方向移动,即放热方向移动;②中温度高,颜色深,则升温平衡向逆方向移动,即吸热方向移动,
故答案为:降温平衡向放热方向移动,升温平衡向吸热方向移动.
点评 本题探究影响化学反应速率的因素以及温度对化学平衡的影响,主要是熟悉用控制变量法进行实验,题目比较简单.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
19.下列物质中,属于高分子化合物的是( )
①蛋白质 ②氨基酸 ③油脂 ④淀粉 ⑤氯乙烯 ⑥纤维素 ⑦聚乙烯.
①蛋白质 ②氨基酸 ③油脂 ④淀粉 ⑤氯乙烯 ⑥纤维素 ⑦聚乙烯.
| A. | 只有①⑦ | B. | 除②外都是 | C. | 只有①③ | D. | 只有①④⑥⑦ |
20.关于有机物C3H6O3的下列叙述一定正确的是( )
| A. | 若能与金属钠和碳酸氢钠反应,则其结构中同时含有-OH和-COOH | |
| B. | 若该物质中含有两个-CH3,则它可以是碳酸酯 | |
| C. | 若该物质中结构中不能只含有C-O键和C-H键 | |
| D. | 若1mol C3H6O3与足量钠反应只产生1mol氢气,说明一分子C3H6O3中含有2个-OH和一个-CHO |
17.下列有关离子方程式的书写不正确的是( )
| A. | 海带中提取碘的氧化过程:H2O2+2I-+2H+=I2+2H2O | |
| B. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液至SO42-恰好沉淀完全:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O | |
| C. | FeCl3溶液中通入过量的H2S气体:2Fe3++H2S=S↓+2Fe2++2H+ | |
| D. |  溶液通入少量CO2: 溶液通入少量CO2: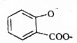 +CO2+H2O→ +CO2+H2O→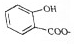 +HCO3- +HCO3- |
4.下列化学用语书写正确的是( )
| A. | 醋酸与NaOH溶液反应的离子方程式为:H++OH-═H2O | |
| B. | 金属钠与乙醇反应的化学方程式为:2Na+2CH3CH2OH→2CH3CH2ONa+H2↑ | |
| C. | 聚氯乙烯的结构简式为: | |
| D. | 工业上制取Cl2的离子方程式为:2Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ |
5.下列说法正确的是( )
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 离子化合物中只含有离子键 | |
| D. | 化学键断裂的变化一定是化学变化 |
12. 硫酸工业生产应考虑综合经济效益问题.
硫酸工业生产应考虑综合经济效益问题.
(1)若从下列四个城市中选择一处建一座硫酸厂,你认为厂址宜选在C的郊区(填标号).
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为4CuFeS2+13O2=4CuO+2Fe2O3+8SO2;
(3)为了有利于SO2转化SO3,多采用如图所示的装有多层催化剂的接触室(填设备名称)作为反应设备,让气体经历如图所示流程而不是直接进入该设备进行反应的原因是使热量能充分利用.
(4)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是D
A.黄铁矿燃烧前需要粉碎,因为大块的黄铁矿不能在空气中 燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中的二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
(5)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据如表信息,结合工业生产实际,选择最合适的生产条件是400℃、1个大气压.
(6)由吸收塔排出的尾气中SO2的含量超过500umol/L,就要用氨水洗涤烟气脱硫,该反应的化学方程式为2NH3•H2O+SO2=(NH4)2SO3+H2O.
(7)若用浓硫酸吸收SO3可以得到H2SO4•SO3.用1000g 98% 的H2SO4充分吸收SO3后,再进行稀释,可以得到98% 的硫酸的质量是C
A.1.98kg B.2.00kg C.2.22kg D.2.42kg.
 硫酸工业生产应考虑综合经济效益问题.
硫酸工业生产应考虑综合经济效益问题.(1)若从下列四个城市中选择一处建一座硫酸厂,你认为厂址宜选在C的郊区(填标号).
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为4CuFeS2+13O2=4CuO+2Fe2O3+8SO2;
(3)为了有利于SO2转化SO3,多采用如图所示的装有多层催化剂的接触室(填设备名称)作为反应设备,让气体经历如图所示流程而不是直接进入该设备进行反应的原因是使热量能充分利用.
(4)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是D
A.黄铁矿燃烧前需要粉碎,因为大块的黄铁矿不能在空气中 燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中的二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
(5)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据如表信息,结合工业生产实际,选择最合适的生产条件是400℃、1个大气压.
| 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 | |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
(7)若用浓硫酸吸收SO3可以得到H2SO4•SO3.用1000g 98% 的H2SO4充分吸收SO3后,再进行稀释,可以得到98% 的硫酸的质量是C
A.1.98kg B.2.00kg C.2.22kg D.2.42kg.
9.能大量共存于同一溶液中的离子组是( )
| A. | Ba2+、K+、SO42- | B. | Ca2+、NO3-、Cl- | C. | Na+、Mg2+、OH- | D. | H+、Cl-、HCO3- |
10.下列属于人工合成的高分子化合物是( )
| A. | 聚氯乙烯 | B. | 淀粉 | C. | 乙酸乙酯 | D. | 苯乙烯 |