题目内容
15.在实验室中用二氧化锰和浓盐酸反应制备干燥的氯气,装置图如图: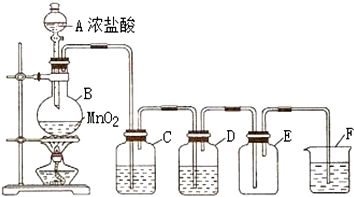
制备氯气的反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(1)在上述反应中,每消耗0.4mol HCl,转移电子数为0.2mol,生成的Cl2的质量为7.1g.
(2)C中装有饱和食盐水,其作用是吸收挥发的HCl气体.
(3)D中所盛试剂是浓H2SO4,作用是吸收水蒸气(或干燥Cl2).
(4)E用的是向上排空气法收集气体.
(5)F中盛放的试剂是NaOH溶液,反应的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O.
分析 (1)依据方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知,参加反应的氯化氢有4mol,只有2mol做还原剂被氧化,生成1mol氯气,转移2,mol电子,据此分析解答;
(2)(3)浓盐酸易挥发,制备的氯气中含有氯化氢、水蒸气杂质,依据氯化氢在饱和食盐水中溶解度不大,浓硫酸具有吸水性的性质可以依次通过盛有饱和食盐水的洗气瓶除去氯化氢,通过盛有浓硫酸的洗气瓶除去水蒸气;
(4)依据氯气密度大于空气密度解答;
(5)氯气有毒,直接排放能引起空气污染,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠水.
解答 解:(1)在MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O反应中,每消耗0.4mol HCl,则有0.2mol氯化氢做还原剂,被氧化生成0.1mol氯气,质量为:0.1mol×71g/mol=7.1g;转移电子数为0.2mol;
故答案为:0.2mol;7.1g;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢在饱和食盐水中溶解度不大,所以可以通过盛有饱和食盐水的洗气瓶C除去氯化氢;
故答案为:吸收挥发的HCl气体;
(3)制备的氯气中含有水蒸汽,浓硫酸具有吸水性,通过盛有浓硫酸的洗气瓶D可以除去氯气中的水蒸气;
故答案为:浓H2SO4;吸收水蒸气(或干燥Cl2);
(4)氯气密度大于空气密度,应采用向上排空气法收集;
故答案为:上;
(5)氯气有毒,直接排放能引起空气污染,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠水,离子方程式:Cl2+2OH-═Cl-+ClO-+H2O,所以可以用盛放氢氧化钠溶液的F吸收过量的氯气;
故答案为:NaOH溶液;Cl2+2OH-═Cl-+ClO-+H2O.
点评 本题考查了氯气的实验室制备,明确氯气实验室制备原理和性质是解题关键,题目难度不大.

| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 离子化合物中只含有离子键 | |
| D. | 化学键断裂的变化一定是化学变化 |
| A. | 一定有乙烯 | B. | 一定有甲烷 | C. | 一定没有甲烷 | D. | 一定没有乙烯 |
| A. | 聚氯乙烯 | B. | 淀粉 | C. | 乙酸乙酯 | D. | 苯乙烯 |
| A. | 碳酸的电离方程式:H2CO3=2H++CO32- | |
| B. | F-的结构示意图: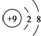 | |
| C. | ${\;}_{55}^{134}$Cs和${\;}_{55}^{137}$Cs形成的单质物理性质相同 | |
| D. | NH3 的电子式: |
| A. | 元素非金属性:Z<R | B. | 元素的原子序数:b>a>c>d | ||
| C. | 离子半径bYn+<cZn- | D. | 最高价氧化物对应水化物碱性:X>Y |
| A. | 各物质的浓度之比c(A):c(B):c(C)=2:3:4 | |
| B. | 平衡混合气体中各物质的浓度相等 | |
| C. | 平衡混合气的体积是反应开始前的$\frac{4}{5}$ | |
| D. | 单位时间内,若消耗了a mol A物质,同时也消耗了2a mol C物质 |
 ,碳氢键之间键角为109°28′.甲烷和氯气在光照下发生取代反应,生成5种产物.产物中CCl4常用作灭火剂.试写出三溴甲烷在光照条件下与溴蒸气反应的化学方程式:CHBr3+Br2$\stackrel{光照}{→}$CBr4+HBr.
,碳氢键之间键角为109°28′.甲烷和氯气在光照下发生取代反应,生成5种产物.产物中CCl4常用作灭火剂.试写出三溴甲烷在光照条件下与溴蒸气反应的化学方程式:CHBr3+Br2$\stackrel{光照}{→}$CBr4+HBr.
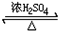 HCOOCH3+H2O
HCOOCH3+H2O