题目内容
19.假设反应N2+3H2?2NH3(正反应为放热反应) 的正反应速率是v1,逆反应速率是v2,当升高温度时,v1和v2的变化情况为( )| A. | 同时增大 | B. | v1减小,v2增大 | C. | 同时减小 | D. | v1增大,v2减小 |
分析 温度升高,化学反应速率增大,与化学反应是吸热反应还是放热反应无关,以此来解答.
解答 解:反应N2+3H2?2NH3(正反应为放热反应) 的正反应速率是v1,逆反应速率是v2,当反应温度升高时,增大活化分子的百分数,反应速率增大,v1和v2都增大,故选A.
点评 本题考查化学反应速率的影响因素,侧重于基本概念的理解和应用,为高考常见题型和高频考点,题目难度不大,注意温度对反应速率的影响.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.能大量共存于同一溶液中的离子组是( )
| A. | Ba2+、K+、SO42- | B. | Ca2+、NO3-、Cl- | C. | Na+、Mg2+、OH- | D. | H+、Cl-、HCO3- |
10.下列属于人工合成的高分子化合物是( )
| A. | 聚氯乙烯 | B. | 淀粉 | C. | 乙酸乙酯 | D. | 苯乙烯 |
7.下列有关化学用语使用及叙述正确的是( )
| A. | 碳酸的电离方程式:H2CO3=2H++CO32- | |
| B. | F-的结构示意图: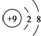 | |
| C. | ${\;}_{55}^{134}$Cs和${\;}_{55}^{137}$Cs形成的单质物理性质相同 | |
| D. | NH3 的电子式: |
14.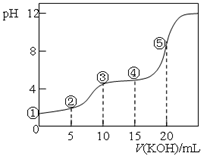 常温下,用0.10mol•L-1 KOH溶液滴定 10.00mL 0.10mol•L-1H2C2O4(二元弱酸)溶液 所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )
常温下,用0.10mol•L-1 KOH溶液滴定 10.00mL 0.10mol•L-1H2C2O4(二元弱酸)溶液 所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )
 常温下,用0.10mol•L-1 KOH溶液滴定 10.00mL 0.10mol•L-1H2C2O4(二元弱酸)溶液 所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )
常温下,用0.10mol•L-1 KOH溶液滴定 10.00mL 0.10mol•L-1H2C2O4(二元弱酸)溶液 所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )| A. | 点①所示溶液中:c(H+)/c(OH-)=1012 | |
| B. | 点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-) | |
| C. | 点③所示溶液中:c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.05mol•L-1 | |
| D. | 点⑤所示溶液中:c(K+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) |
4.四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,对下列叙述的判断正确的是( )
| A. | 元素非金属性:Z<R | B. | 元素的原子序数:b>a>c>d | ||
| C. | 离子半径bYn+<cZn- | D. | 最高价氧化物对应水化物碱性:X>Y |
11.某学习小组用如下装置(支撑仪器略去)探究乙醇的催化氧化反应和乙醛的性质.
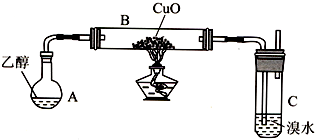
(1)实验开始时,对A进行水浴加热,其目的是产生平稳的乙醇气流.
(2)B中反应方程式为CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O.
(3)若装置C中开始发生倒吸,则采取的应急措施是C(填编号).
A.移去图中的酒精灯B.将C中橡皮塞上的短导气管拔出
C.将B尾端的乳胶管取下D.将A与B之间的乳胶管取下
(4)探究:充分反应后,观察到溴水完全褪色.学习小组通过测定反应前溴水中n(Br2)与反应后溶液中n(Br-)来确定乙醛使溴水褪色的原因.
①假设.请写出假设1的反应类型.
假设1:CH3CHO+Br2→CH2BrCHO+HBr;取代反应
假设2:CH3CHO+Br2→CH3CHBrOBr; 加成反应
假设3:CH3CHO+Br2+H2O→CH3COOH+2HBr. 氧化反应
②结论:若实验测得n(Br2)=0.005mol,n(Br-)=0.01mol,则证明假设3正确.
(5)欲检验乙醇中混有的少量乙醛,甲乙丙三同学设计实验如表:
则上述方案中你认为能正确完成乙醛的检验的是乙(填甲、乙、丙)

(1)实验开始时,对A进行水浴加热,其目的是产生平稳的乙醇气流.
(2)B中反应方程式为CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O.
(3)若装置C中开始发生倒吸,则采取的应急措施是C(填编号).
A.移去图中的酒精灯B.将C中橡皮塞上的短导气管拔出
C.将B尾端的乳胶管取下D.将A与B之间的乳胶管取下
(4)探究:充分反应后,观察到溴水完全褪色.学习小组通过测定反应前溴水中n(Br2)与反应后溶液中n(Br-)来确定乙醛使溴水褪色的原因.
①假设.请写出假设1的反应类型.
假设1:CH3CHO+Br2→CH2BrCHO+HBr;取代反应
假设2:CH3CHO+Br2→CH3CHBrOBr; 加成反应
假设3:CH3CHO+Br2+H2O→CH3COOH+2HBr. 氧化反应
②结论:若实验测得n(Br2)=0.005mol,n(Br-)=0.01mol,则证明假设3正确.
(5)欲检验乙醇中混有的少量乙醛,甲乙丙三同学设计实验如表:
| 试剂、用品 | 预期现象 | |
| 甲 | 酸性高锰酸钾溶液 | 溶液紫红色褪去 |
| 乙 | 溴水 | 溴水褪色 |
| 丙 | 铜丝 酒精灯 | 铜丝由黑色变成光亮的红色 |
8.下列物质的水溶液因水解而呈酸性的是( )
| A. | HCl | B. | CH3COONa | C. | FeCl3 | D. | NaCl |
9.向HNO3和BaCl2的混合溶液中通入SO2,有白色沉淀生成,此沉淀为( )
| A. | FeS | B. | BaSO3 | C. | BaSO4 | D. | S |