题目内容
12.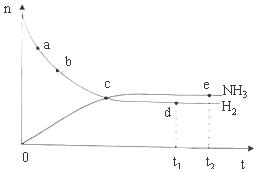 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的小 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 点d(t1时刻)和点e(t2时刻)处H2的转化率相同 |
分析 在N2(g)+3H2(g)?2NH3(g)反应中,随着反应的进行,反应物的物质的量逐渐减少,生成物的物质的量逐渐增多,当达到平衡状态时,正逆反应速率相等,反应物的生成物的物质的量不再改变,曲线为水平直线,以此判断题中各项.
解答 解:A、从a点到b点,氢气的物质的量在逐渐减少,氢气的物质的量浓度在逐渐减少,所以正反应的反应速率在逐渐降低,即点a的正反应速率比点b的大,故A错误;
B、c点反应物和生成物物质的量仍在变化,没有达到平衡状态,所以正逆反应速率不相等,故B错误;
C、d点和e点都处于平衡状态,n(H2)不变,即d点和e点n(H2)相等,所以点d(t1时刻)和点e(t2时刻)处H2的转化率相同,故C错误;
D、在t1时刻和t2时刻,反应都处于化学平衡状态,所以正逆反应速率相等,点d(t1时刻)和点e(t2时刻)处H2的转化率相同,故D正确.
故选D.
点评 本题考查化学平衡图象问题,题目难度中等,注意分析图象中各物理量的变化曲线,把握平衡状态的特征为解答该题的关键.

练习册系列答案
相关题目
15.对于工业合成氨反应:N2+3H2?2NH3,下列说法错误的是( )
| A. | 使用合适的催化剂可以加大反应速率 | |
| B. | 升高温度可以增大反应速率 | |
| C. | 增大N2浓度可以使H2转化率达到100% | |
| D. | 增大N2浓度可以减小反应速率 |
4.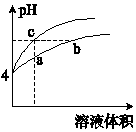 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示.下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示.下列判断正确的是( )
 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示.下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示.下列判断正确的是( )| A. | a、c两点溶液的导电能力相同 | |
| B. | a、b、c三点溶液中水的电离程度:a>b>c | |
| C. | b点溶液中:c(H+)+c(NH3•H2O)=c(OH-) | |
| D. | 用NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体积Vb=Vc |
1.下列反应的离子方程式正确的是( )
| A. | 向NaAlO2溶液中通入少量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 氯化铵溶液与澄清石灰水反应:NH4++OH-?NH3↑+H2O | |
| C. | 碘化亚铁与足量溴水反应:2I-+Br2═I2+2Br- | |
| D. | 氯气溶于水的离子方程式是Cl2+H2O?2H++Cl-+ClO- |
2.实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种.下列根据实验事实得出的结论正确的是( )
| A. | 取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl | |
| B. | 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3 | |
| C. | 取一定量固体,溶解,向溶液中通入足量的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3 | |
| D. | 称取3.80g固体,加热至恒重,质量减少了0.620g.用足量稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,说明原固体中仅含有Na2CO3和NaHCO3 |

 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
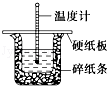 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在图示的装置中进行中和反应,通过测定反应过程中的热量可计算中和热,回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在图示的装置中进行中和反应,通过测定反应过程中的热量可计算中和热,回答下列问题: