题目内容
17.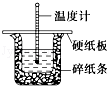 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在图示的装置中进行中和反应,通过测定反应过程中的热量可计算中和热,回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在图示的装置中进行中和反应,通过测定反应过程中的热量可计算中和热,回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
(2)大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大”、“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol•L-1盐酸跟50 mL 0.55mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等”或“不相等”),所求中和热相等(填“相等”或“不相等”),简述理由:中和热为稀的强酸与强碱反应生成1mol时时所放出的热量,与酸碱用量无关.
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会偏小.(均填“偏大”、“偏小”或“无影响”)
分析 中和热测定时,应避免热量的散失而导致实验误差,实验时,烧杯间填满碎纸条,且用硬纸板盖上,且使大小烧杯口相平,为充分反应,可用环形玻璃搅拌棒搅拌,为准确测量中和热,应分别测定实验前酸、碱的温度以及反应后的温度,为减小实验误差,且分别实验3次,稀的强酸与强碱反应生成1mol水时的热量为中和热,物质的量与热量成正比,以此解答该题.
解答 解:(1)实验时应用环形玻璃搅拌棒搅拌,以成分反应,为防止热量散失,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒,
故答案为:环形玻璃搅拌棒;
(2)大烧杯上如不盖硬纸板,导致热量散失,求得的中和热数值偏小,故答案为:偏小;
(3)实验中改用60ml0.50mol/L盐酸跟50ml0.55mol/LNaOH溶液进行反应,NaOH完全反应,生成水的量不同,则放出的热量不同,因中和热为稀的强酸与强碱反应生成1mol时时所放出的热量,与酸碱用量无关,则中和热相等,
故答案为:不相等;相等;中和热为稀的强酸与强碱反应生成1mol时时所放出的热量,与酸碱用量无关;
(4)氨水中一水合氨的电离吸热,则放出热量偏少,测得的中和热的数值会偏小,故答案为:偏小.
点评 本题考查中和热的测定,为高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,题目难度中等,注意理解中和热的概念和测定原理是解题.

练习册系列答案
相关题目
2.下列物质属于电解质并能导电的是( )
| A. | 熔融的NaCl | B. | KNO3溶液 | C. | Cu | D. | 酒精 |
3.下列离子方程式中,属于水解反应的是( )
| A. | HCOOH+H2O?HCOO-+H3O+ | B. | CO32-+H2O?HCO3-+OH- | ||
| C. | CO2+H2O?HCO3-+H+ | D. | HS-?S2-+H+ |
12.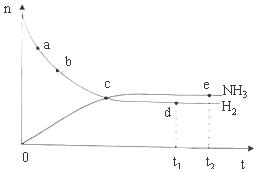 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的小 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 点d(t1时刻)和点e(t2时刻)处H2的转化率相同 |
2.一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z.下列说法正确的是( )
| A. | 0~60 s,以X的浓度变化表示的反应速率为0.001 mol•L-1•s-1 | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
7.有关NaHCO3与Na2CO3的性质,下列叙述中错误的是( )
| A. | Na2CO3和NaHCO3粉末与同浓度盐酸反应,Na2CO3碱性强,反应放出气体速度快 | |
| B. | 等物质的量的两种盐与同浓度的盐酸反应,Na2CO3消耗盐酸的体积是NaHCO3的两倍 | |
| C. | 向Na2CO3饱和溶液中通入过量CO2,有NaHCO3结晶析出 | |
| D. | Na2CO3和NaHCO3溶液分别和BaCl2溶液反应,现象不同 |
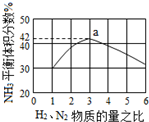 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应.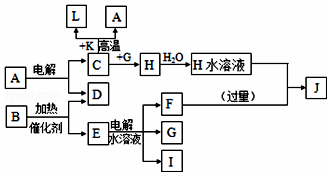 已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末.其转化关系如图:
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末.其转化关系如图: