题目内容
15.对于工业合成氨反应:N2+3H2?2NH3,下列说法错误的是( )| A. | 使用合适的催化剂可以加大反应速率 | |
| B. | 升高温度可以增大反应速率 | |
| C. | 增大N2浓度可以使H2转化率达到100% | |
| D. | 增大N2浓度可以减小反应速率 |
分析 对于反应N2+3H2?2NH3来说,增大压强、浓度以及升高温度、加入催化剂都可增大反应速率,以此解答该题.
解答 解:A.使用催化剂,可增大活化分子百分数,反应速率加快,故A正确;
B.升高温度,可增大活化分子百分数,反应速率加快,故B正确;
C.为可逆反应,转化率不可能达到100%,故C错误;
D.增大N2浓度,单位体积百分数数目增多,增大反应速率,故D错误.
故选CD.
点评 本题考查影响化学反应速率的因素,为高频考点,明确温度、浓度、压强、催化剂对反应速率的影响即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.科学的实验方法为我们探索物质世界提供了一把金钥匙.下列实验方法正确的是( )
| A. | 配制一定物质的量浓度的溶液实验中,定容时,俯视观察刻度线,会引起配制溶液的浓度偏高 | |
| B. | 分液漏斗中上层和下层液体均可以从下口流出 | |
| C. | 冷凝管使用时冷水既可以从上口进也可以从下口进 | |
| D. | 不能用丁达尔效应鉴别Fe(OH)3胶体和CuSO4溶液 |
6.仅用1种试剂即可将酒精、苯酚溶液、己烯、甲苯4种无色溶液区分开来,这种试剂是( )
| A. | Na | B. | FeCl3溶液 | C. | KMnO4酸性溶液 | D. | 溴水 |
3.下列离子方程式中,属于水解反应的是( )
| A. | HCOOH+H2O?HCOO-+H3O+ | B. | CO32-+H2O?HCO3-+OH- | ||
| C. | CO2+H2O?HCO3-+H+ | D. | HS-?S2-+H+ |
10.NA 表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | 实验室用浓盐酸与MnO2反应制Cl2,每生成22.4 LCl2,转移的电子总数为2NA | |
| B. | 1 mol O2在反应中作氧化剂时,所得电子数一定为4NA | |
| C. | 1 mol Na2O2与足量H2O反应,转移电子数为2NA | |
| D. | 0.1 mol金属钠在过量氧气中充分燃烧,生成的化合物中离子总数为0.15NA |
12.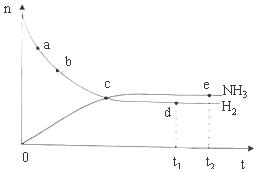 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的小 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 点d(t1时刻)和点e(t2时刻)处H2的转化率相同 |
10.配制下列溶液时常需加入少量括号内的物质,其中不是为了抑制离子水解的是( )
| A. | NaAlO2(NaOH) | B. | SnCl2(HCl) | C. | FeCl3(HCl) | D. | FeSO4(Fe) |
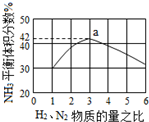 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,氨是最重要的氮肥,是产量最大的化工产品之一.其工业合成原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在密闭容器中,使2mol N2和6mol H2混合发生以上反应.