题目内容
7.氢化镁(MgH2)既可用于劣质燃料的助燃又可同时脱硫脱硝.有关原理如下:MgH2(s)?Mg(s)+H2(g)△H1
2Mg(s)+O2(g)?2MgO(s)△H2
2MgO(s)+2SO2(g)?2MgSO4(s)△H3
(1)①MgH2的电子式为[H:]-Mg2+[H:]-.
②反应:SO2(g)+MgH2(s)+O2?MgSO4(s)+H2(g)的△H=△H1+$\frac{1}{2}$(△H2+△H3)(用含△H1、△H2、△H3
的代数式表示).
(2)1300℃时,不同微粒的MgH2分解时放氢容量与时间的关系如图1所示.

则粒径A、B、C从小到大的顺序是A<B<C.
(3)在2L的恒容密闭容器中加入1molMgO、1molSO2和0.5molO2,发生反应:2MgO(s)+2SO2(g)+O2(g)?2MgSO4(s)△H3,测得SO2的平衡转化率与温度的关系如图2所示.
①该反应的△H3<(填“>”或“<“,下同)0;Q点的反应速率:v(正)>v(逆).
②P点对应温度下该反应的平衡常数为128.
③为提高SO2的转化率,除改变温度外,还可采取的措施有增大压强或者增大氧气的量(任写2点).
(4)镁铝合金(Mg17Ar12)是一种贮氢合金,完全吸氢时生成氢化镁和金属铝,该吸氢反应的化学方程式为Mg17Al12+17H2=17MgH2+12Al.7.32gMg17Ar12完全吸氢后所得的产物与足量稀H2SO4反应,释放出的氢气在标准状况下的体积为11.648L.
分析 (1)①MgH2为离子化合物,据此书写电子式;
②ⅠMgH2(s)?Mg(s)+H2(g)△H1
Ⅱ2Mg(s)+O2(g)?2MgO(s)△H2
Ⅲ2MgO(s)+2SO2(g))+O2(g)?2MgSO4(s)△H3
根据盖斯定律,Ⅰ+$\frac{1}{2}$(Ⅱ+Ⅲ)计算;
(2)根据粒径越小,接触面积越大,反应速率越快,据此分析;
(3)①根据图象测得SO2的平衡转化率随温度升高而增大,说明升温平衡正向移动即吸热方向移动;Q点的SO2的转化率小于平衡点,所以仍然向正向移动,据此分析;
②根据P点SO2的转化率结合该反应的平衡常数K=$\frac{1}{c(SO{\;}_{2}){\;}^{2}c(O{\;}_{2})}$计算;
③提高SO2的转化率,可以改变温度、压强以及增大氧气的量使平衡正向进行即可;
(4)Mg17Al12与氢气反应生成氢化镁和金属铝,氢化镁和金属铝与足量稀H2SO4反应生成氢气,举行计算.
解答 解:(1)①MgH2为离子化合物,电子式为[H:]-Mg2+[H:]-,故答案为:[H:]-Mg2+[H:]-;
②ⅠMgH2(s)?Mg(s)+H2(g)△H1
Ⅱ2Mg(s)+O2(g)?2MgO(s)△H2
Ⅲ2MgO(s)+2SO2(g))+O2(g)?2MgSO4(s)△H3
根据盖斯定律,Ⅰ+$\frac{1}{2}$(Ⅱ+Ⅲ)得SO2(g)+MgH2(s)+O2?MgSO4(s)+H2(g)的△H=△H1+$\frac{1}{2}$(△H2+△H3),故答案为:△H1+$\frac{1}{2}$(△H2+△H3);
(2)因为粒径越小,接触面积越大,反应速率越快,由图象可知,反应速率A>B>C,所以粒径A、B、C从小到大的顺序是A<B<C,故答案为:A<B<C;
(3)①根据图象测得SO2的平衡转化率随温度升高而增大,说明升温平衡正向移动即吸热方向移动,则△H3<0;Q点的SO2的转化率小于平衡点,所以仍然向正向移动,则v(正)>v(逆),故答案为:<;>;
②由图可知P点SO2的转化率为0.5,所以平衡时剩余0.5molSO2和0.25molO2,又K=$\frac{1}{c(SO{\;}_{2}){\;}^{2}c(O{\;}_{2})}$=$\frac{1}{(\frac{0.5}{2}){\;}^{2}×(\frac{0.25}{2})}$=128,故答案为:128;
③提高SO2的转化率,可以改变温度、压强以及增大氧气的量使平衡正向进行,所以除改变温度外,还可采取的措施有增大压强或者增大氧气的量,故答案为:增大压强或者增大氧气的量;
(4)Mg17Al12与氢气反应生成氢化镁和金属铝,化学方程式为:Mg17Al12+17H2=17MgH2+12Al,所以7.32g即$\frac{7.32g}{732g/mol}$=0.01molMg17Al12生成0.17molMgH2和0.12mol金属铝,又氢化镁和金属铝与足量稀H2SO4反应方程式分别为:MgH2+H2SO4=MgSO4+2H2↑,2Al+3H2SO4=Al2(SO4)3+3H2↑,所以生成氢气在标准状况下的体积为(0.17mol×2+0.12mol×$\frac{3}{2}$)×22.4L/mol=11.648L,故答案为:Mg17Al12+17H2=17MgH2+12Al;11.648L.
点评 本题考查了电子式的书写、盖斯定律的应用、化学平衡的移动原理以及相关方程式的计算,掌握基础是解题关键,题目难度中等.注重图象的分析应用.

 阅读快车系列答案
阅读快车系列答案已知:
S2O82-+2I-?2SO42-+I2(慢)
I2+2S2O32-?2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3 耗尽后,溶液颜色将由无色变为蓝色
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如表:
| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
| A. | 实验室用浓盐酸与MnO2反应制Cl2,每生成22.4 LCl2,转移的电子总数为2NA | |
| B. | 1 mol O2在反应中作氧化剂时,所得电子数一定为4NA | |
| C. | 1 mol Na2O2与足量H2O反应,转移电子数为2NA | |
| D. | 0.1 mol金属钠在过量氧气中充分燃烧,生成的化合物中离子总数为0.15NA |
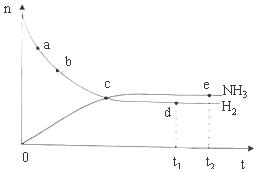 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的小 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 点d(t1时刻)和点e(t2时刻)处H2的转化率相同 |
| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增加 | |
| B. | 对于有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 | |
| C. | 改变条件能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的有效碰撞几率 | |
| D. | 对于本来不能发生的化学反应,改变条件可以使反应发生 |
| 混合物成分 | 除杂试剂 | 化学方程式 |
| (1)铜粉中混有铁粉 | ||
| (2)铁粉中混有铝粉 | ||
| (3)Al2O3中混有Al(OH)3 | ||
| (4)FeCl3溶液中混有FeCl2 |
| A. | 用Na2O2和H2O 反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 用氢氧化钠溶液除去金属铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 用食醋除去水瓶中的水垢:2CH3COOH+CO32-═2CH3COO-+CO2↑+H2O | |
| D. | 等体积、等浓度的Ba(OH)2浓溶液和NH4HCO3 浓溶液混合后并加热Ba2++OH-+HCO3-═BaCO3↓+2H2O |