题目内容
20.将电解质分为强、弱电解质的依据是( )| A. | 在一定条件下的电离程度 | B. | 属于离子化合物还是共价化合物 | ||
| C. | 熔融状态下是否完全电离 | D. | 溶于水后的导电能力是强还是弱 |
分析 强电解质完全电离,弱电解质存在电离平衡,以此来解答.
解答 解:利用电离的程度判断强、弱电解质,与化合物类别、溶于水能否导电无关,HCl为强电解质,但HCl熔融不能电离,
故选A.
点评 本题考查弱电解质电离平衡及判断,为高频考点,把握判断的依据及化学键、溶液导电原因等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
10.某化学兴趣小组欲研究稀H2SO4、NaCl、KCl、Na2CO3、FeCl3、NaOH的性质,对于如何研究,他们设计了两种实验方案:
方案①:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验;
方案②:将它们按照钠盐、钾盐、铁盐和其他化合物分类,然后分别溶于水得到溶液,进行实验.
下列说法正确的是( )
方案①:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验;
方案②:将它们按照钠盐、钾盐、铁盐和其他化合物分类,然后分别溶于水得到溶液,进行实验.
下列说法正确的是( )
| A. | 常温时,将少量铜粉分别投入上述溶液中,按照方案①的分类,能够完全溶解铜粉的只有稀硫酸溶液 | |
| B. | 设计方案②的同学取某种溶液,在其中加入上述的钾盐溶液,有白色沉淀产生,再加入稀硝酸,沉淀不消失,则该溶液中可能含有Ag+ | |
| C. | 按照方案①的分类,属于碱的有Na2CO3、NaOH | |
| D. | 该化学兴趣小组同学在研究物质性质时只使用了实验法、观察法 |
11.从平时学生实验中我们发现,同学们在进行实验时出现许多不正确的操作方式,希望同学们在今后的实验中,应该克服不规范的操作.请找出下列图示中正确的实验操作( )
| A. | 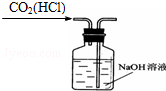 除去CO2中的HCl | B. | 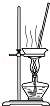 蒸发氯化钠溶液 | ||
| C. | 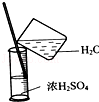 稀释浓硫酸 | D. | 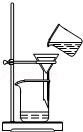 过滤 |
8.关于碱金属的叙述不正确的是( )
| A. | 熔点:Li>Na>K>Rb>Cs | |
| B. | 碱性:LiOH<NaOH<KOH<RbOH<CsOH | |
| C. | 与水反应的剧烈程度:Li<Na<K<Rb<Cs | |
| D. | 都能在空气中燃烧生成R2O(R表示碱金属) |
5.a、b、c、d是四种短周期元素.a、b、d同周期,c、d同主族.a的原子结构示意图为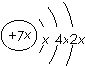 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为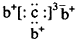 .下列比较中正确的是( )
.下列比较中正确的是( )
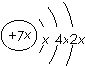 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为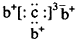 .下列比较中正确的是( )
.下列比较中正确的是( )| A. | 原子半径:a>c>d>b | B. | 非金属性 b>d>c | ||
| C. | 原子序数:d>a>c>b | D. | 最高价含氧酸的酸性c>d>a |
12.首次成功解释了氢原子光谱的科学家是( )
| A. | 道尔顿 | B. | 卢瑟福 | C. | 玻尔 | D. | 爱因斯坦 |
9.弱酸HCN溶液中存在着下列平衡:HCN?H++CN-,若要使平衡逆向移动,同时使c(H+)增大,应加入适量的下列物质是( )
| A. | 硫酸 | B. | NaOH固体 | C. | NaCN固体 | D. | 水 |
10.扁桃酸(Mandelic Acid)是一种医药中间体,用于合成环扁桃酸酯等,其结构简式为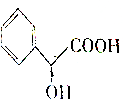 下列说法正确的是( )
下列说法正确的是( )
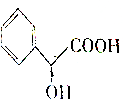 下列说法正确的是( )
下列说法正确的是( )| A. | 扁桃酸分子至多有10个原子在同一平面 | |
| B. | 扁桃酸在一定条件下能发生消去反应 | |
| C. | 某酯与扁桃酸互为同分异构体,苯环上有2个取代基且能与氯化铁发生显色反应,该酯的结构有3种 | |
| D. | 由苯乙烯(C6H5CH=CH2)合成扁桃酸需经过加成→水解→氧化→还原等步骤 |