题目内容
18.下列化合物中,不能由单质直接化合得到的是( )| A. | NO | B. | Na2O2 | C. | FeCl2 | D. | CuCl2 |
分析 金属单质与氯气反应得到最高价的金属氯化物,钠燃烧生成过氧化钠,铜在氯气中反应生成氯化铜,氮气和氧气反应生成一氧化氮.
解答 解:A.在放电条件下,氮气和氧气反应生成一氧化氮,故A不选;
B.钠在空气中燃烧生成过氧化钠,和氧气在没有条件下反应生成氧化钠,故B不选;
C.Fe和氯气在点燃时能直接生成FeCl3,不能化合生成氯化亚铁,故C选;
D.铜和氯气发生反应生成氯化铜,可以单质化合生成,故D不选,
故选C.
点评 本题考查金属及非金属的性质,明确氯气具有强氧化性,与变价金属反应生成最高价金属氯化物是解答本题的关键,较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.关于碱金属的叙述不正确的是( )
| A. | 熔点:Li>Na>K>Rb>Cs | |
| B. | 碱性:LiOH<NaOH<KOH<RbOH<CsOH | |
| C. | 与水反应的剧烈程度:Li<Na<K<Rb<Cs | |
| D. | 都能在空气中燃烧生成R2O(R表示碱金属) |
9.弱酸HCN溶液中存在着下列平衡:HCN?H++CN-,若要使平衡逆向移动,同时使c(H+)增大,应加入适量的下列物质是( )
| A. | 硫酸 | B. | NaOH固体 | C. | NaCN固体 | D. | 水 |
13.第101号元素钔最稳定的一种原子可以表示为${\;}_{101}^{258}Md$,该原子所含中子的数目为( )
| A. | 56 | B. | 157 | C. | 258 | D. | 101 |
3.世界上60%的镁是从海水中提取的,其主要步骤如下:
①把贝壳制成石灰乳
②在海水中加入石灰乳,过滤,洗涤沉淀物
③将沉淀物与盐酸反应,结晶、过滤
④在氯化氢热气流中干燥晶体
⑤电解上述晶体的熔融物.
下列说法正确的是( )
①把贝壳制成石灰乳
②在海水中加入石灰乳,过滤,洗涤沉淀物
③将沉淀物与盐酸反应,结晶、过滤
④在氯化氢热气流中干燥晶体
⑤电解上述晶体的熔融物.
下列说法正确的是( )
| A. | 镁元素在元素周期表中位于第三周期、第ⅡB族 | |
| B. | 第②步洗涤完毕后向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净 | |
| C. | 在工业生产上可用NaOH溶液代替石灰乳 | |
| D. | 步骤⑤也可以采用电解该晶体水溶液的方法 |
10.扁桃酸(Mandelic Acid)是一种医药中间体,用于合成环扁桃酸酯等,其结构简式为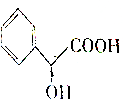 下列说法正确的是( )
下列说法正确的是( )
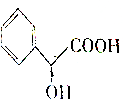 下列说法正确的是( )
下列说法正确的是( )| A. | 扁桃酸分子至多有10个原子在同一平面 | |
| B. | 扁桃酸在一定条件下能发生消去反应 | |
| C. | 某酯与扁桃酸互为同分异构体,苯环上有2个取代基且能与氯化铁发生显色反应,该酯的结构有3种 | |
| D. | 由苯乙烯(C6H5CH=CH2)合成扁桃酸需经过加成→水解→氧化→还原等步骤 |
4.下列有关实验原理、方法和结论都正确的是( )
| A. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 向某无色溶液中加入稀盐酸无现象,再加入BaCl2溶液产生白色沉淀,证明含SO42ˉ | |
| D. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
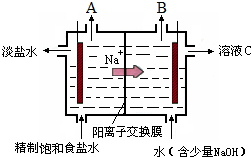 氯碱工业中电解饱和食盐水的原理示意图如图所示:
氯碱工业中电解饱和食盐水的原理示意图如图所示: