题目内容
19.Na和Na+两种粒子中,不相同的是( )①核内质子数
②最内层电子数
③最外层电子数
④核外电子层数.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②③④ |
分析 Na原子失去最外层的一个电子变为Na+,核内质子数不变、原子序数不变,钠原子最外层电子数为1,而钠离子最外层电子数为8.
解答 解:①Na原子失去一个电子变为Na+,核内质子数不变,Na和Na+具有相同质子数,故①不选;
②Na原子失去最外层的一个电子变为Na+,最内层电子数不变,都为2,故②不选;
③Na失去一个电子变为Na+,最外层电子数由1个变成8个,故③选;
④Na失去一个电子变为Na+,电子层数由3个变成2个,核外电子数由11个变成10个,故④选;
故选C.
点评 本题考查原子和离子的区别,难度不大,掌握原子与离子之间的转化、元素的概念等是正确解答本题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.向铁和氧化铁的混合物中加入足量的稀H2SO4,充分反应后生成FeSO4溶液,当生成的Fe2+和H2的物质的量之比为4:1时,被氧化的铁与被还原的铁的物质的量之比是( )
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 1:3 |
10.某化学兴趣小组欲研究稀H2SO4、NaCl、KCl、Na2CO3、FeCl3、NaOH的性质,对于如何研究,他们设计了两种实验方案:
方案①:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验;
方案②:将它们按照钠盐、钾盐、铁盐和其他化合物分类,然后分别溶于水得到溶液,进行实验.
下列说法正确的是( )
方案①:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验;
方案②:将它们按照钠盐、钾盐、铁盐和其他化合物分类,然后分别溶于水得到溶液,进行实验.
下列说法正确的是( )
| A. | 常温时,将少量铜粉分别投入上述溶液中,按照方案①的分类,能够完全溶解铜粉的只有稀硫酸溶液 | |
| B. | 设计方案②的同学取某种溶液,在其中加入上述的钾盐溶液,有白色沉淀产生,再加入稀硝酸,沉淀不消失,则该溶液中可能含有Ag+ | |
| C. | 按照方案①的分类,属于碱的有Na2CO3、NaOH | |
| D. | 该化学兴趣小组同学在研究物质性质时只使用了实验法、观察法 |
7.下列化学用语正确的是( )
| A. | H2S的电子式:H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{S}}{••}$${\;}_{•}^{•}$]2-H+ | |
| B. | Mg2+的结构示意图: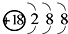 | |
| C. | Na2O的电子式:Na${\;}_{2}^{+}$[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2- | |
| D. | N2的电子式: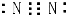 |
14.下列有关离子方程错误的是( )
| A. | 将Fe加入CuSO4溶液中 Fe+Cu2+═Cu+Fe2+ | |
| B. | 向氯化铝溶液中加入足量氨水 Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| C. | 向Ca(OH)2溶液中通入过量 SO2SO2+OH-═HSO3- | |
| D. | 往水玻璃中加入盐酸 SiO32-+2H+═H2SiO3↓ |
4.下列溶液中的Cl-浓度与1mol/LMgCl2溶液中的Cl-浓度相等的是( )
| A. | 1mol/L NaCl溶液 | B. | 1 mol/LCaCl2溶液 | ||
| C. | 1 mol/L KCl溶液 | D. | 1 mol/LAlCl3溶液 |
11.从平时学生实验中我们发现,同学们在进行实验时出现许多不正确的操作方式,希望同学们在今后的实验中,应该克服不规范的操作.请找出下列图示中正确的实验操作( )
| A. | 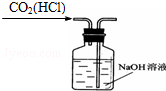 除去CO2中的HCl | B. |  蒸发氯化钠溶液 | ||
| C. | 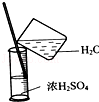 稀释浓硫酸 | D. | 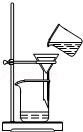 过滤 |
8.关于碱金属的叙述不正确的是( )
| A. | 熔点:Li>Na>K>Rb>Cs | |
| B. | 碱性:LiOH<NaOH<KOH<RbOH<CsOH | |
| C. | 与水反应的剧烈程度:Li<Na<K<Rb<Cs | |
| D. | 都能在空气中燃烧生成R2O(R表示碱金属) |
9.弱酸HCN溶液中存在着下列平衡:HCN?H++CN-,若要使平衡逆向移动,同时使c(H+)增大,应加入适量的下列物质是( )
| A. | 硫酸 | B. | NaOH固体 | C. | NaCN固体 | D. | 水 |