题目内容
19.图中每一方框中表示一种反应物或生成物,其中A、C、D、E在通常情况下均为气体,B为液体,(图中有些反应的产物和反应条件没有标出).试回答: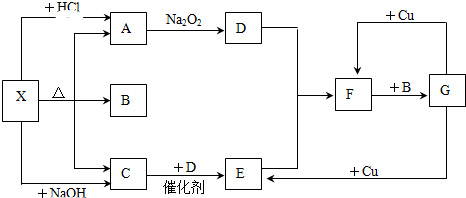
(1)X是NH4HCO3或(NH4)2CO3,C是NH3,F是NO2.
(2)写出A→D反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
(3)写出G→E反应的化学方程式3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O.
(4)写出C→E反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
分析 A、C、D、E在通常情况下均为气体,X能与盐酸、氢氧化钠反应都生成气体,应为弱酸铵盐,X受热分解生成A、B、C,B为液体,B为H2O,X与盐酸反应得到气体A,A能与过氧化钠反应生成气体D,则A为CO2、D为O2,X与氢氧化钠反应得到气体C,C能经过两步 氧化得F,F与B反应生成G,G与铜反应生成E,则C为NH3,E为NO,F为NO2,G为HNO3,硝酸能与Cu反应生成NO、NO2,根据A、B、C可推知可以推知X为NH4HCO3,据此解答.
解答 解:A、C、D、E在通常情况下均为气体,X能与盐酸、氢氧化钠反应都生成气体,应为弱酸铵盐,X受热分解生成A、B、C,B为液体,B为H2O,X与盐酸反应得到气体A,A能与过氧化钠反应生成气体D,则A为CO2、D为O2,X与氢氧化钠反应得到气体C,C能经过两步 氧化得F,F与B反应生成G,G与铜反应生成E,则C为NH3,E为NO,F为NO2,G为HNO3,硝酸能与Cu反应生成NO、NO2,根据A、B、C可推知可以推知X为NH4HCO3或(NH4)2CO3,
(1)根据上面的分析可知,X为NH4HCO3或(NH4)2CO3,C为NH3,F为NO2,
故答案为:NH4HCO3或(NH4)2CO3;NH3;NO2;
(2)A→D为二氧化碳与过氧化钠反应生成碳酸钠和氧气,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)G→E为铜与稀硝酸反应生成硝酸铜与一氧化氮,反应的化学方程式 为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,
故答案为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
(4)C→E为氨的催化氧化,反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
点评 本题考查无机物推断,难度中等,注意根据X既能与盐酸又能与氢氧化钠反应生成气体及A能与过氧化钠反应生成气体进行推断,熟练掌握氮及其化合的相互转化是解题的关键.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案| A. | FeCl2溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl- | |
| B. | Mg(OH)2与盐酸的反应:OH-+H+═H2O | |
| C. | Al(OH)3沉淀中滴加盐酸:Al(OH)3+3H+═Al3++3H2O | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
| A. | 负极发生的反应为:Fe-3e-═Fe3+ | |
| B. | 正极发生的反应为:2H2O+O2+2e-═4OH- | |
| C. | 原电池是将电能转变为化学能的装置 | |
| D. | 钢柱在水下部分比在空气与水交界处更难腐蚀 |
| A. | 二氧化碳能灭火,所以燃着的镁条在二氧化碳中便熄灭 | |
| B. | 硬铝的硬度比铝大,熔点比铝低 | |
| C. | 相同质量的铜分别跟足量的浓硝酸或稀硝酸反应,产生气体的体积比为1:1 | |
| D. | 相同质量的铝分别跟足量的稀盐酸酸或氢氧化钠溶液共热,产生气体体积相同 |
| A. | 溶质的电离方程式为NaHCO3=Na++H++CO32- | |
| B. | 25℃时,加水稀释后,n(H+)与n( OH-)的乘积变大 | |
| C. | 离子浓度关系:c( Na+)+c(H+)=c( OH-)+c( HCO3- )+c( CO32-) | |
| D. | 温度升高,c(HCO3-)增大 |
| A. | 开始加入合金的质量可能为3.0 g | |
| B. | 参加反应的硝酸的物质的量是0.1 mol | |
| C. | 完全生成沉淀时消耗NaOH溶液的体积为100 mL | |
| D. | 溶解合金时收集到NO气体的体积为2.24 L |