题目内容
10.制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题:方案一:把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀过滤(填操作名称)、洗涤、烘干、称量、计算.洗涤沉淀的具体操作是沿玻璃棒缓慢地向过滤器中加蒸馏水至浸没沉淀物,使水自然流下,重复2~3次.
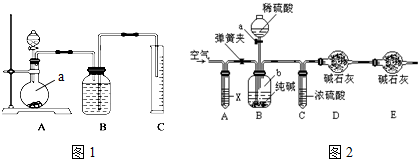
方案二:把一定量的样品与足量硫酸反应后,用图1所示装置测定产生CO2的体积,为了确保测定结果的准确性,B中的溶液最好采用饱和NaHCO3溶液.图1装置中实验仪器a的名称是圆底烧瓶.
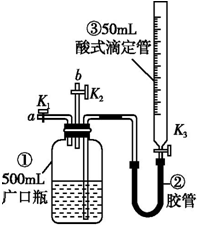
方案三:利用图2所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下:
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰的干燥管D的质量为33.4g;
③准确称得6g纯碱样品放入容器b中;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为35.6g.
(1)若④⑤两步的实验操作太快,则会导致测定结果偏小(填“偏大”或“偏小”).
(2)装置A中试剂X应选用NaOH溶液.
(3)E装置的作用是防止空气中CO2和水蒸气进入D中.
(4)根据实验中测得的有关数据,计算纯碱样品Na2CO3的质量分数为88.3%(结果保留小数点后一位).
分析 方案一:分离固液混合物的方法为过滤;洗涤沉淀的操作是在过滤器中加水浸没沉淀使水自然留下,重复操作2-3次;
方案二:把一定量的混合物与足量硫酸反应,然后用如图装置测定产生的CO2气体的体积,是利用排液法测定生成二氧化碳的气体体积进行计算,广口瓶中液体是饱和碳酸氢钠;根据装置图分析;
方案三:(1)实验操作太快,则二氧化碳不能完全被碱石灰吸收;
(2)X的作用是吸收空气中的二氧化碳;
(3)空气中的二氧化碳和水蒸气进入D中会影响实验;
(4)分析实验前后装置D质量变化,并由此质量差计算样品中碳酸钠的质量,求出样品中碳酸钠的质量分数.
解答 解:方案一:样品溶解后加入过量的CaCl2溶液会生成碳酸钙沉淀,分离固液混合物的方法为过滤,洗涤沉淀的操作是沿玻璃棒缓慢地向过滤器中加蒸馏水至浸没沉淀物,使水自然流下,重复操作2-3次;
故答案为:过滤;沿玻璃棒缓慢地向过滤器中加蒸馏水至浸没沉淀物,使水自然流下,重复2~3次;
方案二:把一定量的样品与足量硫酸反应后,然后用如图装置测定产生的CO2气体的体积,是利用排液法测定生成二氧化碳的气体体积,在饱和碳酸氢钠溶液中二氧化碳不反应,溶解度最小,所以B中的溶液最好采用饱和NaHCO3溶液;由装置图可知下图装置中实验仪器a为圆底烧瓶;
故答案为:饱和NaHCO3溶液;圆底烧瓶;
方案三:(1)反应过快会使产生的气体二氧化碳没能完全被D装置中碱石灰吸收;快速鼓入空气,也会使装置内残留二氧化碳不能被D装置中碱石灰完全吸收;则测得的二氧化碳质量偏小,所以测定结果偏小;
故答案为:偏小;
(2)鼓入空气,可把残留在装置B、C中二氧化碳全部由D中碱石灰吸收,因为空气中含有二氧化碳,因此应把鼓入的空气中的二氧化碳吸收处理,所以装置A应放入氢氧化钠溶液;
故答案为:NaOH溶液;
(3)如果D装置直接与外界空气相连通,则空气中的水和二氧化碳会对测定结果带来影响,所以装置E的作用则是防止空气中水和二氧化碳进入装置D中;
故答案为:防止空气中CO2和水蒸气进入D中;
(4)反应中放出二氧化碳气体的质量=85.6g-83.4g=2.2g
设放出2.2g二氧化碳消耗碳酸钠的质量为x
Na2CO3~CO2
106 44
x 2.2g
解得 x=5.3g
纯碱样品Na2CO3的质量分数=$\frac{5.3g}{6g}$×100%≈88.3%
故答案为:88.3%.
点评 本题考查了物质含量的测定、物质性质的探究和实验基本操作,主要是实验过程的分析,掌握基本操作是解题关键,题目难度中等,测定二氧化碳质量时注意空气中的成分对实验的影响.

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案| A. | Fe2+、Na+、NO3-、Cl- | B. | Ba2+、Na+、NO3-、Cl- | ||
| C. | SO42-、SO32-、NH4+、Na+ | D. | Mg2+、Na+、Br-、AlO2- |
| A. |  称量 | B. | 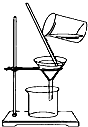 转移 | ||
| C. |  过滤 | D. |  蒸馏 |
| A. | Ca2+、Fe2+、NO3-、HCO3- | B. | H+、Ba2+、Cl-、NO3- | ||
| C. | K+、AlO2-、Cl-、SO42- | D. | Na+、Cl-、CO32-、SO32- |
| A. | 在Ba(OH)2溶液中,c(Ba2+)=2c(OH-) | |
| B. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 | |
| C. | 在难溶电解质的饱和溶液中,电解质的Ksp越小,其物质的量浓度越小 | |
| D. | 反应5S2O82-+2Mn2++8H20═10SO42-+2MnO4-+16H+,得电子的元素是氧元素,反应中转移10e- |
 +Cl3$\stackrel{一定条件}{→}$
+Cl3$\stackrel{一定条件}{→}$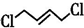
 ;
;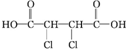 +4NaOH$\stackrel{△}{→}$
+4NaOH$\stackrel{△}{→}$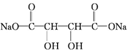 +2NaCl+2H2O;
+2NaCl+2H2O;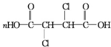 +n
+n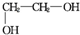 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$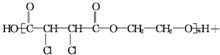
 某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理.
某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理.