题目内容
11.下列叙述中正确的是( )| A. | 二氧化碳能灭火,所以燃着的镁条在二氧化碳中便熄灭 | |
| B. | 硬铝的硬度比铝大,熔点比铝低 | |
| C. | 相同质量的铜分别跟足量的浓硝酸或稀硝酸反应,产生气体的体积比为1:1 | |
| D. | 相同质量的铝分别跟足量的稀盐酸酸或氢氧化钠溶液共热,产生气体体积相同 |
分析 A.燃着的镁条与二氧化碳发生化学反应;
B.合金的硬度一般比组分金属的大,熔点一般比组成金属的低;
C.根据3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O、Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O分析;
D.根据2Al+2NaOH+2H2O═2NaAlO2+3H2↑、2Al+6HCl═2AlCl3+3H2↑分析.
解答 解:A.燃着的镁条与二氧化碳发生化学反应,因此不会熄灭,故A错误;
B.合金的硬度一般比组分金属的大,熔点一般比组成金属的低,故B正确;
C.一定质量的铜分别与足量的稀硝酸和浓硝酸完全反应,发生3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O、Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,等量的Cu与酸反应,浓硝酸反应生成气体多,故C错误;
D.由2Al+2NaOH+2H2O═2NaAlO2+3H2↑、2Al+6HCl═2AlCl3+3H2↑可知,2molAl分别与足量酸、碱反应都生成3molH2,则两份等量的铝粉分别与足量酸、碱反应生成等量的氢气,氢气的物质的量之比等于其体积之比,则相同状态下产生的气体体积之比是1:1,故D正确;
故选BD.
点评 本题考查了元素及其重要化合物的性质,关键是清楚发生的化学反应,可以利用电子转移守恒判断,难度不大.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
2.下列说法正确的是( )
| A. | 在Ba(OH)2溶液中,c(Ba2+)=2c(OH-) | |
| B. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 | |
| C. | 在难溶电解质的饱和溶液中,电解质的Ksp越小,其物质的量浓度越小 | |
| D. | 反应5S2O82-+2Mn2++8H20═10SO42-+2MnO4-+16H+,得电子的元素是氧元素,反应中转移10e- |
6.已知:相关物质的溶度积常数见表:
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2•2H2O晶体,按如图步骤进行提纯:

(1)最适合作氧化剂X的是C(填字母),加入X的目的是将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.(I2+2S2O32-═S4O62-+2I-)
①可选用淀粉溶液作滴定指示剂.②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95%.
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |

(1)最适合作氧化剂X的是C(填字母),加入X的目的是将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.(I2+2S2O32-═S4O62-+2I-)
①可选用淀粉溶液作滴定指示剂.②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95%.
16.已知:2CO(g)+O2(g)═2CO2(g)△H=-565.2kJ•molˉ1,下列说法不正确的是( )
| A. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.6 kJ•molˉ1 | |
| B. | 2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量小于565.2 kJ | |
| C. | 相同条件下,2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量 | |
| D. | 拆开2mol CO和1mol O2的化学键所需总能量低于形成2mol CO2化学键所放出总能量 |
3.在标准状况下,1 L的密闭容器中恰好可盛放n个N2分子和m个H2分子组成的混合气体,则阿伏加德罗常数的数值可近似表示为( )
| A. | 22.4(m+n) | B. | 22.4×6.02×1023(m+n) | ||
| C. | 22.4×6.02×1032(m+n) | D. | $\frac{6.02×1{0}^{23}(m+n)}{22.4}$ |
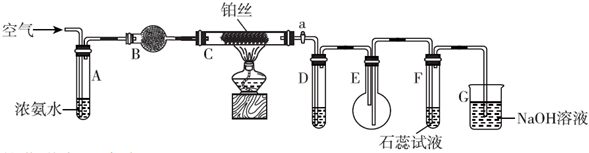
 某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理.
某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理.