��Ŀ����
7�������ȣ�SO2Cl2����һ�ֻ���ԭ�ϣ��������й���Ϣ��������Ϊ��ɫҺ�壬�۵�Ϊ-54.1�棬�е�Ϊ69.1�棬�ڳ�ʪ�����С����̡���100�����Ͽ�ʼ�ֽ⣬���ɶ���������������Ȼ����Ǻϳ������ȵij��÷�������֪��SO2��g��+Cl2��g��$\stackrel{����}{?}$SO2Cl2��l����H=-97.3kJ/mol��ʵ���Һϳɷ�Ӧ��ʵ��װ����ͼ1��ʾ���ش��������⣺
��1������A������Ϊ�����ܻ����������ܣ�����̿�������Ǵ�����B�м����ҩƷ�Ǽ�ʯ�ң�
ʵ��ʱ������C�зų���Һ�IJ��������Ǵ�Һ©���IJ������������Բ������İ�����©���ľ���С����������ת����ʹҺ�����£�
��2��װ�ö��з�����Ӧ�����ӷ���ʽΪCl-+ClO-+2H+=Cl2��+H20�����������ƹ����Ũ�����Ʊ�������������ʱ����Ҫ���Ʒ�Ӧ�ٶȣ�ͼ2�п�ѡ�õķ���װ����a����д��ĸ����

��3���Ȼ��ᣨClSO3H�����ȷֽ⣬Ҳ���Ƶ�������������һ�����ʣ��÷�Ӧ�Ļ�ѧ����ʽΪ2ClSO3H$\frac{\underline{\;\;��\;\;}}{\;}$SO2Cl2+H2SO4���������ķ���������
��4����ȱ��װ���ң������Ͷ���������ܷ�����Ӧ�Ļ�ѧ����ʽΪSO2+Cl2+2H20=H2SO4+2HCl��
Ϊ��߱�ʵ���������ȵIJ��ʣ���ʵ������л���Ҫע��������У�ֻ��һ�����ɣ������������ʣ��������˿죮
���� ��1����ͼ��֪���������ƣ�����̿�ɼӿ췴Ӧ���ʣ�B�п����ü�ʯ�����չ�����������������������C����Һ©�����зų�Һ�壬Ҫ���������ӣ�
��2�������Ʊ�����������������Ư�۷�Ӧ�������������������ƹ����Ũ�����Ʊ�������������ʱ����Ҫ���Ʒ�Ӧ�ٶȣ����÷�Һ©������Һ������٣�
��3��ClSO3H���ȷֽ⣬Ҳ���Ƶ�������������һ�����ʣ���ԭ���غ��֪�������ᣬ����������ʵķе㲻ͬ��
��4��ȱ��װ���ң������Ͷ���������������ԭ��Ӧ������������Ϊ��߱�ʵ���������ȵIJ��ʣ��������ʡ��¶ȵ���������ʣ�
��� �⣺��1����ͼ��֪����A������Ϊ�����ܻ����������ܣ�����̿�ɼӿ췴Ӧ���ʣ������̿�������Ǵ�����B�п����ü�ʯ�����չ�����������������������C����Һ©������ʵ��ʱ������C�зų���Һ�IJ��������Ǵ�Һ©���IJ������������Բ������İ�����©���ľ���С����������ת����ʹҺ�����£�
�ʴ�Ϊ�������ܻ����������ܣ���������ʯ�ң���Һ©���IJ������������Բ������İ�����©���ľ���С����������ת����ʹҺ�����£�
��2�������Ʊ�����������������Ư�۷�Ӧ�����������������ӷ�ӦΪCl-+ClO-+2H+=Cl2��+H20�����������ƹ����Ũ�����Ʊ�������������ʱ����Ҫ���Ʒ�Ӧ�ٶȣ����÷�Һ©������Һ������٣�ֻ��a���ϣ�
�ʴ�Ϊ��Cl-+ClO-+2H+=Cl2��+H20��a��
��3��ClSO3H���ȷֽ⣬Ҳ���Ƶ�������������һ�����ʣ���ԭ���غ��֪�������ᣬ��ӦΪ2ClSO3H$\frac{\underline{\;\;��\;\;}}{\;}$SO2Cl2+H2SO4������������ʵķе㲻ͬ����������ķ���Ϊ����
�ʴ�Ϊ��2ClSO3H$\frac{\underline{\;\;��\;\;}}{\;}$SO2Cl2+H2SO4������
��4��ȱ��װ���ң������Ͷ���������������ԭ��Ӧ������������ᣬ��ӦΪSO2+Cl2+2H20=H2SO4+2HCl��Ϊ��߱�ʵ���������ȵIJ��ʣ���ʵ������л���Ҫע��������п����������ʣ��������˿죨����������ƿ���̣����ʵ����£�����ͨ����ˮ����������������Ͳ�Ʒ���ٽ���ʵ�飩��
�ʴ�Ϊ��SO2+Cl2+2H20=H2SO4+2HCl�������������ʣ��������˿죮
���� ���⿼���Ʊ�ʵ�鷽������ƣ�Ϊ��Ƶ���㣬�����Ʊ�ԭ����ʵ��װ�õ����á�ʵ�鼼��Ϊ���Ĺؼ������ط�����ʵ�������Ŀ��飬��Ŀ�ѶȲ���

 ��ĩ���䵥Ԫ�����ิϰ��ϵ�д�
��ĩ���䵥Ԫ�����ิϰ��ϵ�д�| A�� | 2.0mol/L | B�� | 0.24mol/L | C�� | 0.19 mol/L | D�� | 3 mol/L |
| A�� |  ���� | B�� | 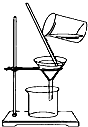 ת�� | ||
| C�� |  ���� | D�� |  ���� |
| A�� | ��Ba��OH��2��Һ�У�c��Ba2+��=2c��OH-�� | |
| B�� | ���ǡ����ۡ���֬����ˮ������Ϊ�ǵ���� | |
| C�� | �����ܵ���ʵı�����Һ�У�����ʵ�KspԽС�������ʵ���Ũ��ԽС | |
| D�� | ��Ӧ5S2O82-+2Mn2++8H20�T10SO42-+2MnO4-+16H+���õ��ӵ�Ԫ������Ԫ�أ���Ӧ��ת��10e- |
| A�� | 2.2mol | B�� | 1.2mol | C�� | 0.6mol | D�� | 1.0mol |
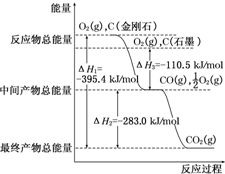
| A�� | CO��g��+$\frac{1}{2}$O2��g���TCO2��g����H=-282.6 kJ•mol��1 | |
| B�� | 2mol CO��g����1mol O2��g����Ӧ����2mol CO2��s���ų�����С��565.2 kJ | |
| C�� | ��ͬ�����£�2mol CO��g����1mol O2��g��������������2mol CO2��g���������� | |
| D�� | ��2mol CO��1mol O2�Ļ�ѧ�����������������γ�2mol CO2��ѧ�����ų������� |
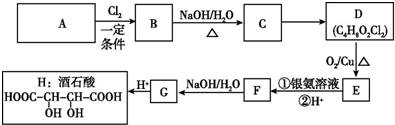
 +Cl3$\stackrel{һ������}{��}$
+Cl3$\stackrel{һ������}{��}$
 ��
��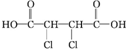 +4NaOH$\stackrel{��}{��}$
+4NaOH$\stackrel{��}{��}$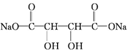 +2NaCl+2H2O��
+2NaCl+2H2O��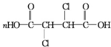 +n
+n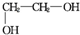 $\stackrel{һ������}{��}$
$\stackrel{һ������}{��}$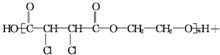
 ��1������Һ��������Ҫ�ɷ�֮һ�Ƕ��飨C4H10������1g������ȫȼ�ղ�����CO2��Һ̬ˮʱ���ų�����50kJ����д������ȼ�շ�Ӧ���Ȼ�ѧ����ʽ
��1������Һ��������Ҫ�ɷ�֮һ�Ƕ��飨C4H10������1g������ȫȼ�ղ�����CO2��Һ̬ˮʱ���ų�����50kJ����д������ȼ�շ�Ӧ���Ȼ�ѧ����ʽ