题目内容
8.下列关于0.10mol/L NaHCO3溶液的说法正确的是( )| A. | 溶质的电离方程式为NaHCO3=Na++H++CO32- | |
| B. | 25℃时,加水稀释后,n(H+)与n( OH-)的乘积变大 | |
| C. | 离子浓度关系:c( Na+)+c(H+)=c( OH-)+c( HCO3- )+c( CO32-) | |
| D. | 温度升高,c(HCO3-)增大 |
分析 A.碳酸氢根离子不可拆分;
B.加水稀释后,促进HCO3-水解,但Kw不变;
C.溶液遵循电荷守恒;
D.HCO3-水解为吸热反应,升高温度,促进水解.
解答 解:A.NaHCO3为强电解质,溶质的电离方程式为NaHCO3═Na++HCO3-,故A错误;
B.25℃时,加水稀释后,促进HCO3-水解,n(OH-)增大,c(OH-)减小,由Kw不变,可知c(H+)增大,则n(H+)增大,则n(H+)与n(OH-)的乘积变大,故B正确;
C.由电荷守恒可知,离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故C错误;
D.HCO3-水解为吸热反应,升高温度,促进水解,则c(HCO3-)减小,故D错误;
故选B.
点评 本题为2014年福建高考化学试题,涉及电离、水解及溶液中离子浓度关系的考查,选项B为解答的易错点,注意稀释促进水解时浓度与物质的量的变化不同,题目难度中等.

练习册系列答案
相关题目
18.下列实验操作中,正确的是( )
| A. |  称量 | B. | 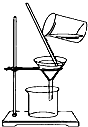 转移 | ||
| C. | 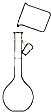 过滤 | D. |  蒸馏 |
16.已知:2CO(g)+O2(g)═2CO2(g)△H=-565.2kJ•molˉ1,下列说法不正确的是( )
| A. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282.6 kJ•molˉ1 | |
| B. | 2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量小于565.2 kJ | |
| C. | 相同条件下,2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量 | |
| D. | 拆开2mol CO和1mol O2的化学键所需总能量低于形成2mol CO2化学键所放出总能量 |
3.在标准状况下,1 L的密闭容器中恰好可盛放n个N2分子和m个H2分子组成的混合气体,则阿伏加德罗常数的数值可近似表示为( )
| A. | 22.4(m+n) | B. | 22.4×6.02×1023(m+n) | ||
| C. | 22.4×6.02×1032(m+n) | D. | $\frac{6.02×1{0}^{23}(m+n)}{22.4}$ |
13.化学与生活密切相关.下列生活中常见物质的俗名与化学式相对应的是( )
| A. | 苏打--NaHCO3 | B. | 胆矾--ZnSO4 | C. | 酒精--C2H5OH | D. | 生石灰--Ca(OH)2 |
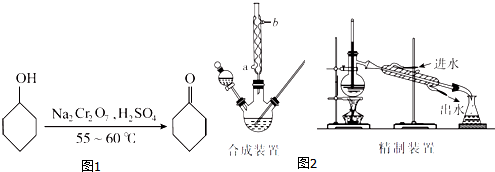
18.环己酮(如图1)是一种重要的化工原料,实验室常用下列原理和装置制备(部分夹持仪器未画出)(如图2):
环己醇、环己酮和水的部分物理性质见下表(*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点):
(1)已知合成环己酮的反应是放热反应,反应剧烈将导致体系温度迅速上升,副反应增多.实验时,先在合成装置中加入5.2 mL(5 g)环己醇和几粒沸石,再加入酸性Na2Cr2O7溶液.酸性Na2Cr2O7溶液的加料方式为B(填代号).
A.一次性加入
B.缓慢加入
C.无所谓,怎样加入都可以
(2)若酸性Na2Cr2O7溶液的体积为35 mL,则应选取100mL(填“100 mL”或“250 mL”)的三颈瓶.
(3)反应完成后,加入适量水,蒸馏,收集95~100℃的馏分(设为A),其主要成分是环己酮和水的混合物.
(4)合成装置中冷凝管的作用是冷凝回流,冷凝水从冷凝管的a(填“a”或“b”)口进入.
(5)在馏分A中加入氯化钠固体至饱和,振荡、静置、分液,得有机层(设为B).加入氯化钠固体的作用是降低有机物在水层得溶解度,有利于液体分层.
(6)在有机层B中加入无水硫酸镁固体,除去其中的少量水分.过滤,将滤液置于精制装置中蒸馏,收集B(填代号)的馏分,得到纯净的环己酮.
A.100.0~102.0℃
B.154.0~156.0℃
C.160.0~162.0℃
(7)精制装置中的错误是温度计的水银球未与蒸馏烧瓶支管口平齐(或冷凝水进、出口方向颠倒).(任写一点)
(8)若最终得到环己酮的质量为3.43 g,则环己酮的产率是70%.

环己醇、环己酮和水的部分物理性质见下表(*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点):
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 100 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己酮 | 98 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 18 | 100.0 | 0.9982 |
A.一次性加入
B.缓慢加入
C.无所谓,怎样加入都可以
(2)若酸性Na2Cr2O7溶液的体积为35 mL,则应选取100mL(填“100 mL”或“250 mL”)的三颈瓶.
(3)反应完成后,加入适量水,蒸馏,收集95~100℃的馏分(设为A),其主要成分是环己酮和水的混合物.
(4)合成装置中冷凝管的作用是冷凝回流,冷凝水从冷凝管的a(填“a”或“b”)口进入.
(5)在馏分A中加入氯化钠固体至饱和,振荡、静置、分液,得有机层(设为B).加入氯化钠固体的作用是降低有机物在水层得溶解度,有利于液体分层.
(6)在有机层B中加入无水硫酸镁固体,除去其中的少量水分.过滤,将滤液置于精制装置中蒸馏,收集B(填代号)的馏分,得到纯净的环己酮.
A.100.0~102.0℃
B.154.0~156.0℃
C.160.0~162.0℃
(7)精制装置中的错误是温度计的水银球未与蒸馏烧瓶支管口平齐(或冷凝水进、出口方向颠倒).(任写一点)
(8)若最终得到环己酮的质量为3.43 g,则环己酮的产率是70%.
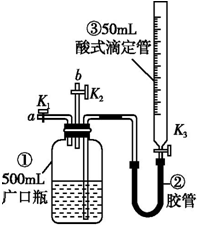 某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理.
某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理.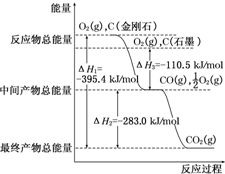 (1)家用液化气中主要成分之一是丁烷(C4H10).当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ.试写出丁烷燃烧反应的热化学方程式
(1)家用液化气中主要成分之一是丁烷(C4H10).当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ.试写出丁烷燃烧反应的热化学方程式