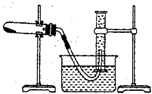
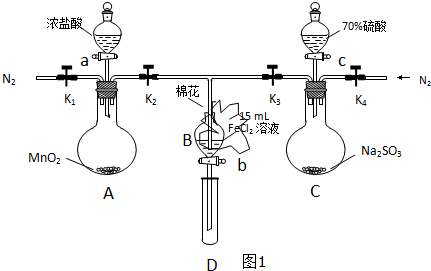
题目内容
 电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点.如图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图.
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点.如图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图.下列示意图中,能正确表示用NH3?H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
A、 |
B、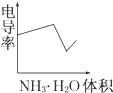 |
C、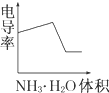 |
D、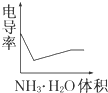 |
考点:电解质溶液的导电性
专题:
分析:醋酸和一水合氨是弱电解质,在溶液里部分电离,氯化氢是强电解质,完全电离,向混合溶液中滴加氨水,氨水先和氯化氢反应生成强电解质氯化铵,氯化氢完全反应后,氨水再和醋酸反应生成强电解质醋酸铵,根据溶液中离子浓度变化与电导率的关系分析解答.
解答:
解:氯化氢是强电解质,醋酸是弱电解质,滴加的弱电解质先和氯化氢反应生成强电解质氯化铵,但溶液体积不断增大,溶液被稀释,所以电导率下降;当氯化氢完全被中和后,一水合氨继续电离与弱电解质醋酸反应生成强电解质醋酸铵,所以电导率增大;醋酸也完全反应后,继续滴加氨水,因为溶液被稀释,电导率有下降趋势,
故选D.
故选D.
点评:本题考查了酸碱中和溶液电导率的变化,明确电导率与离子浓度的关系是解本题关键,根据电解质的强弱、离子浓度的变化来分析解答即可,难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、盐溶液都是中性的 |
| B、盐溶液的酸碱性与盐的类型无关 |
| C、NaHCO3溶液显酸性 |
| D、碳酸钠溶液显碱性,溶液中c(OH-)>c(H+) |
下列分散系能产生丁达尔效应的是( )
| A、硫酸铜溶液 | B、稀硫酸 |
| C、石灰浆 | D、氢氧化铁胶体 |
下列比较不正确的是( )
| A、等浓度的NH4HSO4、NH3?H2O、(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的五种溶液,其中(NH4)2Fe(SO4)2溶液中c(NH4+)最大 |
| B、NaClO和BaCl2混合溶液:c(Na+)+2c(Ba2+)=c(ClO-)+c(HClO)+c(Cl-) |
| C、25℃下,0.2 mol?L-1 HCl溶液与0.2 mol?L-1 YOH(一元弱碱)溶液等体积混合(忽略混合后溶液体积的变化),则c(Cl-)=c(Y+)+c(YOH)=0.2 mol?L-1 |
| D、常温下,将0.2 mol?L-1某一元碱ROH溶液和0.1 mol?L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) |