题目内容
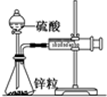 某温度下按如图安装好实验装置,在锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL 2.5mol?L-1的硫酸,将产生的H2收集在一个注射器中,用时10s时恰好收集到气体的体积为50mL(若折合成0℃、101kPa条件下的H2体积为44.8mL),在该温度下,下列说法不正确的是( )
某温度下按如图安装好实验装置,在锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL 2.5mol?L-1的硫酸,将产生的H2收集在一个注射器中,用时10s时恰好收集到气体的体积为50mL(若折合成0℃、101kPa条件下的H2体积为44.8mL),在该温度下,下列说法不正确的是( )| A、用锌粒表示10 s内该反应的速率为0.013 g?s-1 |
| B、忽略锥形瓶溶液体积的变化,用H+来表示10 s该反应的速率0.01 mol?(L?s)-1 |
| C、忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内反应的速率0.01 mol?(L?s)-1 |
| D、用H2表示10 s内该反应的速率为0.004 mol?(L?s)-1 |
考点:测定某些化学反应的速率
专题:化学反应速率专题
分析:根据生产氢气的体积计算消耗氢离子的物质的量、消耗锌的质量,
A.根据速率单位选择计算方法:固体质量的变化量和时间的比值;
B.根据速率表达式计算以氢离子表示的反应速率;
C.再根据速率之比等于化学计量数之比判断;
D.根据速率v=
来计算即可.
A.根据速率单位选择计算方法:固体质量的变化量和时间的比值;
B.根据速率表达式计算以氢离子表示的反应速率;
C.再根据速率之比等于化学计量数之比判断;
D.根据速率v=
| △c |
| △t |
解答:
解:Zn+2H+=Zn2++H2↑
65g 1mol 1mol 22.4L
0.13g 0.004mol 0.002mol 0.0448L
A.用锌粒来表示10s内该反应的速率为
=0.013g/s,故A正确;
B.v(H+)=
=0.01mol/(L?s),故B正确;
C.v(Zn2+)=
v(H+)=0.005mol/(L?s),故C错误;
D.用H2来表示10s内该反应的速率为
=0.004mol?(L?s)-1,故D正确;
故选C.
65g 1mol 1mol 22.4L
0.13g 0.004mol 0.002mol 0.0448L
A.用锌粒来表示10s内该反应的速率为
| 0.13g |
| 10s |
B.v(H+)=
| ||
| 10s |
C.v(Zn2+)=
| 1 |
| 2 |
D.用H2来表示10s内该反应的速率为
| ||||
| 10s |
故选C.
点评:本题考查了反应速率的表示.注意速率可有不同的表示方法,常用单位时间内浓度变化表示.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案
相关题目
下列说法正确的是( )
| A、纯净物一定由分子构成 |
| B、同种分子构成的物质一定是纯净物 |
| C、混合物肯定由两种以上元素组成 |
| D、盐中一定含有金属元素 |
下列分散系能产生丁达尔效应的是( )
| A、硫酸铜溶液 | B、稀硫酸 |
| C、石灰浆 | D、氢氧化铁胶体 |
 ,其中取代基-Y中不含支链,含有碳碳双键,咖啡酸有如下转化关系:
,其中取代基-Y中不含支链,含有碳碳双键,咖啡酸有如下转化关系:
 ,试写出D的属于芳香醇的其中2种同分异构体是
,试写出D的属于芳香醇的其中2种同分异构体是