题目内容
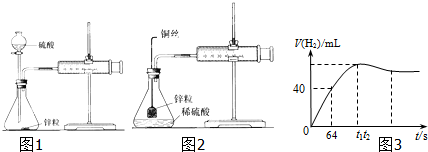
为探究苯和溴的取代反应,甲用如图所示的装置Ⅰ进行如下实验:将一定量的苯与溴放在烧瓶中,同时加入少量铁屑,3~5min后发现装有AgNO3溶液的锥形瓶中有浅黄色的沉淀生成,即证明苯和溴发生了取代反应.
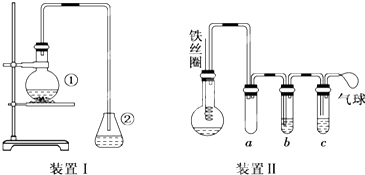
(1)装置I中①的化学方程式为 , .
(2)①中长导管的作用是 .
(3)烧瓶中生成的红褐色油状液滴的成分是 ,要想得到纯净的产物,可用 试剂洗涤.洗涤后分离产品应使用的仪器是 .
(4)甲做实验时,乙观察到烧瓶中液体沸腾并有红棕色气体从导管中逸出,提出必须先除去红棕色气体,才能验证锥形瓶中的产物,原因是 .
(5)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验.可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳.a的作用是 ,b中的试剂是 ,比较两套装置,装置Ⅱ的主要优点是:(答出两点即可)① ;② .

(1)装置I中①的化学方程式为
(2)①中长导管的作用是
(3)烧瓶中生成的红褐色油状液滴的成分是
(4)甲做实验时,乙观察到烧瓶中液体沸腾并有红棕色气体从导管中逸出,提出必须先除去红棕色气体,才能验证锥形瓶中的产物,原因是
(5)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验.可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳.a的作用是
考点:性质实验方案的设计
专题:实验题
分析:(1)溴与铁反应生成溴化铁,苯和液溴在溴化铁的催化作用下生成溴苯和溴化氢;
(2)长导管让挥发出来的溴单质冷凝,防止对产物的干扰;
(3)反应生成的硝基苯和溴互溶呈红褐色油状液滴,可用NaOH溶液试剂洗涤,让反应生成溶于水的物质,再进行分液;
(4)验证先首先要除杂,否则挥发出的溴蒸气也能与硝酸银溶液反应产生AgBr浅黄色沉淀;
(5)支管是短进短出a的作用是防止倒吸安全装置;b中要除去Br2,b中试剂为苯或四氯化碳,装置Ⅱ的主要优点是①防止倒吸;②可以控制反应进行程度;③避免杂质干扰;④防止污染空气.
(2)长导管让挥发出来的溴单质冷凝,防止对产物的干扰;
(3)反应生成的硝基苯和溴互溶呈红褐色油状液滴,可用NaOH溶液试剂洗涤,让反应生成溶于水的物质,再进行分液;
(4)验证先首先要除杂,否则挥发出的溴蒸气也能与硝酸银溶液反应产生AgBr浅黄色沉淀;
(5)支管是短进短出a的作用是防止倒吸安全装置;b中要除去Br2,b中试剂为苯或四氯化碳,装置Ⅱ的主要优点是①防止倒吸;②可以控制反应进行程度;③避免杂质干扰;④防止污染空气.
解答:
解:(1)因溴与铁反应生成溴化铁:2Fe+3Br2═2FeBr3,苯和液溴在溴化铁的催化作用下生成溴苯和溴化氢: ,
,
故答案为:2Fe+3Br2═2FeBr3; ;
;
(2)反应为放热反应,长导管让挥发出来的溴单质冷凝,防止对产物的干扰,即长导管的作用为导气,冷凝回流,
故答案为:导气,冷凝回流;
(3)反应生成的硝基苯和溴互溶呈红褐色油状液滴,可用NaOH溶液试剂洗涤,让反应生成溶于水的物质,再进行分液,
故答案为 与Br2;NaOH溶液(或水);分液漏斗;
与Br2;NaOH溶液(或水);分液漏斗;
(4)验证先首先要除杂,否则挥发出的溴蒸气也能与硝酸银溶液反应产生AgBr浅黄色沉淀,
故答案为:挥发出的溴蒸气也能与硝酸银溶液反应产生AgBr浅黄色沉淀;
(5)从图上信息可知,支管是短进短出a的作用是防止倒吸安全装置.b中要除去Br2,试剂为苯或四氯化碳.根据以上分析,装置Ⅱ的主要优点是①防止倒吸;②可以控制反应进行程度;③避免杂质干扰;④防止污染空气,
故答案为:防止倒吸安全装置;苯或四氯化碳;防止倒吸;可以控制反应进行程度.
 ,
,故答案为:2Fe+3Br2═2FeBr3;
 ;
;(2)反应为放热反应,长导管让挥发出来的溴单质冷凝,防止对产物的干扰,即长导管的作用为导气,冷凝回流,
故答案为:导气,冷凝回流;
(3)反应生成的硝基苯和溴互溶呈红褐色油状液滴,可用NaOH溶液试剂洗涤,让反应生成溶于水的物质,再进行分液,
故答案为
 与Br2;NaOH溶液(或水);分液漏斗;
与Br2;NaOH溶液(或水);分液漏斗;(4)验证先首先要除杂,否则挥发出的溴蒸气也能与硝酸银溶液反应产生AgBr浅黄色沉淀,
故答案为:挥发出的溴蒸气也能与硝酸银溶液反应产生AgBr浅黄色沉淀;
(5)从图上信息可知,支管是短进短出a的作用是防止倒吸安全装置.b中要除去Br2,试剂为苯或四氯化碳.根据以上分析,装置Ⅱ的主要优点是①防止倒吸;②可以控制反应进行程度;③避免杂质干扰;④防止污染空气,
故答案为:防止倒吸安全装置;苯或四氯化碳;防止倒吸;可以控制反应进行程度.
点评:本题主要考查了苯的性质实验,掌握反应的原理、各物质的性质以及操作的方法是解题的关键.

练习册系列答案
相关题目
下列中和反应对应的离子方程式能以“H++OH-═H2O”表示的是( )
| A、醋酸和氢氧化钠溶液反应 |
| B、氢氧化镁和盐酸反应 |
| C、澄清石灰水和硝酸反应 |
| D、氢氧化钡和稀硫酸反应 |
下列说法正确的是( )
| A、Al-Mg合金焊接过程中使用的保护气为N2 |
| B、工业上可采用电解熔融NaCl的方法制备金属钠 |
| C、将0.5molN2和1.5molH2充入一密闭容器中充分反应,放出热量19.6KJ,则该热化学方程式为N2(g)+3 H2(g)?2NH3(g)△H=-39.2 KJ?mol-1 |
| D、已知:2H2(g)+O2(g)?2H2O(g)△H=-486 KJ?mol-1,则H2的燃烧热△H为-243 KJ?mol-1 |
下列说法正确的是( )
| A、盐溶液都是中性的 |
| B、盐溶液的酸碱性与盐的类型无关 |
| C、NaHCO3溶液显酸性 |
| D、碳酸钠溶液显碱性,溶液中c(OH-)>c(H+) |