题目内容
20.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )| A. | 25℃时,1L pH=12的Ba(OH)2溶液中含有的OH-的数目为0.02NA | |
| B. | 标准状况下,11.2 L乙醇所含的羟基数为0.5NA | |
| C. | 1 mol Fe与1 mol Cl2反应转移电子数一定为3NA | |
| D. | 常温常压下,19g H3O+含有10NA个电子 |
分析 A.常温下pH=12的氢氧化钡溶液中氢氧根离子的浓度为0.01mol/L,1L该溶液中含有0.01mol氢氧根离子;
B.标准状况下乙醇不是气体;
C.1mol氯气与铁完全反应最多得到2mol电子;
D. H3O+中含有10个电子,其摩尔质量为19g/mol.
解答 解:A.25℃时,1L pH=12的Ba(OH)2溶液中氢氧根离子的浓度为0.01mol/L,1L该溶液中含有氢氧根离子的物质的量为0.01mol,含有的OH-的数目为0.01NA,故A错误;
B.标准状况下,乙醇的状态不是气体,不能使用标准状况下的气体摩尔体积计算,故B错误;
C.1 mol Fe与1 mol Cl2反应最多得到2mol电子,故C错误;
D.19g H3O+的物质的量为:$\frac{19g}{19g/mol}$=1mol,1mol H3O+中含有10mol电子,故D正确;
故选D.
点评 本题考查了物质的量的计算,题目难度不大,注意明确标准状况下气体摩尔体积的使用条件,熟练掌握物质的量与摩尔质量、阿伏伽德罗常数之间的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.某学生对铁与水蒸气反应进行实验探究:
(1)铁粉和水蒸气反应的化学方程式3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2.
(2)操作II检验反应生成了氢气,说明水具有氧化性(填“氧化性”或“还原性”).
(3)为检验黑色固体成分,取操作IV得到的黄色溶液于两试管中,分别进行如下实验:
a.向试管1中滴加2滴KSCN溶液,溶液变红色;
b.向试管2中滴加2滴K3[Fe(CN)6]溶液,出现蓝色沉淀.
①实验a的目的是检验黄色溶液中存在Fe3+.
②由实验a、b不能判断黑色固体是磁性氧化铁,依据是操作IV中有少量气体生成,未反应完的铁也可以和盐酸反应生成Fe2+.
③该同学通过计算证实了黑色固体一定不是磁性氧化铁纯净物,n≠1.38m.(用m的表达式表示)
(4)资料表明:铁件与水蒸气反应,在表面生成的磁性氧化铁膜可对铁件起到防护作用.运用图1所示装置对该资料进行验证(已知:用铜片、铁件X、电解液构成原电池;氧化膜有保护时,电压会减小).
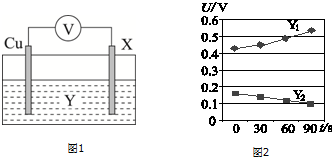
a.当Y为饱和氯化钠时,实验结果如下表:
依据U1<0.91(V),证明该条件下磁性氧化铁膜有保护作用.
b.表面有磁性氧化铁膜但存在少量缺陷的铁片作X,分别用0.1mol/LH2SO4溶液和0.1mol/L CuSO4溶液作Y进行验证实验,得到图2:
①Y2代表的溶液是0.1mol/LCuSO4溶液.
②用离子方程式解释Y1曲线变化的原因:Fe3O4+8H+=Fe2++2Fe3++4H2O..
| 操作 | 现象或结果 |
| I.取m g 铁粉,在水蒸气中加热一段时间 | 灰黑色铁粉变成黑色 |
| II.用排水集气法收集一小试管气体,移近到燃着 的酒精灯火焰 | 发出爆鸣声 |
| III.将黑色固体干燥、称量 | 得到n g 黑色固体 |
| IV.将黑色固体加入到过量的盐酸中 | 固体溶解,有少量气体生成,得到黄色溶液 |
(2)操作II检验反应生成了氢气,说明水具有氧化性(填“氧化性”或“还原性”).
(3)为检验黑色固体成分,取操作IV得到的黄色溶液于两试管中,分别进行如下实验:
a.向试管1中滴加2滴KSCN溶液,溶液变红色;
b.向试管2中滴加2滴K3[Fe(CN)6]溶液,出现蓝色沉淀.
①实验a的目的是检验黄色溶液中存在Fe3+.
②由实验a、b不能判断黑色固体是磁性氧化铁,依据是操作IV中有少量气体生成,未反应完的铁也可以和盐酸反应生成Fe2+.
③该同学通过计算证实了黑色固体一定不是磁性氧化铁纯净物,n≠1.38m.(用m的表达式表示)
(4)资料表明:铁件与水蒸气反应,在表面生成的磁性氧化铁膜可对铁件起到防护作用.运用图1所示装置对该资料进行验证(已知:用铜片、铁件X、电解液构成原电池;氧化膜有保护时,电压会减小).

a.当Y为饱和氯化钠时,实验结果如下表:
| X | U/V |
| 纯铁片 | 0.91 |
| 表面有磁性氧化铁膜的铁片 | U1 |
b.表面有磁性氧化铁膜但存在少量缺陷的铁片作X,分别用0.1mol/LH2SO4溶液和0.1mol/L CuSO4溶液作Y进行验证实验,得到图2:
①Y2代表的溶液是0.1mol/LCuSO4溶液.
②用离子方程式解释Y1曲线变化的原因:Fe3O4+8H+=Fe2++2Fe3++4H2O..
8.下列描述正确的是( )
| A. | 实验室制取乙酸乙酯的方程式为:CH3COOH+H18O-C2H5$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H${\;}_{2}^{\;}$18O | |
| B. | 向某溶液中滴加KSCN溶液,溶液呈血红色,证明存在Fe3+而没有Fe2+ | |
| C. | 常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸 | |
| D. | 沉淀溶解达到平衡时,溶液中溶质的离子浓度不一定相等,但保持不变 |
15.第3周期某元素的原子,其最外层3p亚层上有一个未成对电子,则关于该元素的描述正确的是( )
| A. | 该元素最高价氧化物的水化物肯定是一种强酸 | |
| B. | 该元素单质肯定是一种黄绿色的气体 | |
| C. | 该元素的最高价氧化物肯定能与强碱反应 | |
| D. | 该元素的原子半径在同周期中肯定是最小的(稀有气体元素除外) |
5.下列说法不正确的是( )
| A. | 用洁净铂丝蘸取未知溶液进行焰色反应,呈黄色火焰,则该溶液有Na+,但不能确定K+的存在 | |
| B. | 实验室制取乙酸乙酯时,向试管中加入乙醇,然后边摇动试管边慢慢加入浓硫酸和冰醋酸 | |
| C. | 用已知浓度NaOH溶液滴定未知浓度盐酸,滴定终点时,俯视刻度线,则测得盐酸浓度偏小 | |
| D. | 相同温度下,可以通过观察气泡多少来比较不同浓度Na2SO3溶液与稀H2SO4溶液反应的快慢 |
9.下列物质中碳元素含量最高的是( )
| A. | 甲烷 | B. | 乙烷 | C. | 乙烯 | D. | 苯 |
3.下列各组元素性质递变情况错误的是( )
| A. | Li、Be、B原子最外层电子数依次升高 | |
| B. | P、S、Cl元素最高正化合价依次升高 | |
| C. | B、C、N、O、F原 子半径依次升高 | |
| D. | Li、Na、K的原子半径依次增大 |
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空: