题目内容
3.下列各组元素性质递变情况错误的是( )| A. | Li、Be、B原子最外层电子数依次升高 | |
| B. | P、S、Cl元素最高正化合价依次升高 | |
| C. | B、C、N、O、F原 子半径依次升高 | |
| D. | Li、Na、K的原子半径依次增大 |
分析 A.Li、Be、B原子最外层电子数分别为1、2、3;
B.P、S、Cl元素最高正化合价分别为+5、+6、+7;
C.同周期从左向右原子半径减小;
D.同主族从上到下原子半径增大.
解答 解:A.Li、Be、B原子最外层电子数分别为1、2、3,则最外层电子数依次升高,故A正确;
B.P、S、Cl元素最高正化合价分别为+5、+6、+7,则最高正化合价依次升高,故B正确;
C.同周期从左向右原子半径减小,则B、C、N、O、F原子半径依次减小,故C错误;
D.同主族从上到下原子半径增大,则Li、Na、K的原子半径依次增大,故D正确;
故选C.
点评 本题考查元素周期律和周期表的应用,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 25℃时,1L pH=12的Ba(OH)2溶液中含有的OH-的数目为0.02NA | |
| B. | 标准状况下,11.2 L乙醇所含的羟基数为0.5NA | |
| C. | 1 mol Fe与1 mol Cl2反应转移电子数一定为3NA | |
| D. | 常温常压下,19g H3O+含有10NA个电子 |
18.1mol下列有机物中与足量的NaHCO3溶液反应.可得2molCO2的是( )
| A. |  | B. | HOCH2CH2OH | C. | HOOC-COOH | D. | CH3COOH |
5.下列状态的物质,既能导电又属于电解质的是( )
| A. | MgCl2晶体 | B. | NaCl溶液 | C. | 液态HCl | D. | 熔融的NaOH |
8.下列物质在常温下发生水解时,对应的离子方程式正确的是( )
| A. | Na2CO3溶液:CO32-+2H2O?H2CO3+2OH- | |
| B. | NH4Cl溶液:NH4++H2O?NH3•H2O+H+ | |
| C. | CuSO4溶液:Cu2++2H2O?Cu(OH)2↓+2H+ | |
| D. | NaClO溶液:ClO-+H2O═HClO+OH- |
15.钒是一种熔点很高的金属,具有良好的可塑性和低温抗腐蚀性,有延展性、硬度大,无磁性.广泛应用于钢铁、航空航天、能源、化工等领域.中铝集团 (平果铝业公司)目前使用一种新型工艺,以便从铝业生成的固体废料--赤泥中提取金属钒,具体工艺流程图如下:
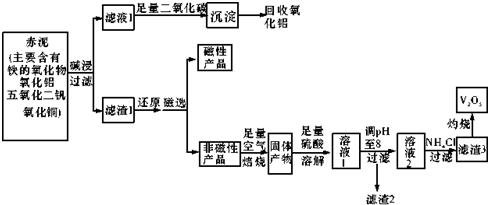
已知:I.钒有多种价态,其中+5价最稳定.钒在溶液中主要以V02+和V03-的形式存在,存在平衡V02++H20?V03-+2H+.
Ⅱ.部分含钒物质在水中的溶解性如下表所示:
Ⅲ.部分离子的沉淀pH值:
请回答下列问题:
(1)碱浸步骤中最好选用a.
a.Na0H溶液b.氨水 c.纯碱溶液
(2)写出滤液1与足量二氧化碳反应的离子方程式AlO2-+CO2+2H2O=Al(OH)3+HCO3-;.
(3)磁选步骤得到的磁性产品为铁.
(4)溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铜离子,二是使使VO2+转化为VO3-.
(5)滤渣3的主要成分为NH4VO3,工业上常用铝热反应法由V205冶炼金属钒,请写出反应的化学方程式3V205+10Al$\frac{\underline{\;高温\;}}{\;}$6V+5Al203.

已知:I.钒有多种价态,其中+5价最稳定.钒在溶液中主要以V02+和V03-的形式存在,存在平衡V02++H20?V03-+2H+.
Ⅱ.部分含钒物质在水中的溶解性如下表所示:
| 物质 | V205 | NH4V03 | (V02)2S04 |
| 溶解性 | 难溶 | 难溶 | 易溶 |
| Cu2+ | Fe2+ | Fe3+ | |
| 开始沉淀pH值 | 5.2 | 7.6 | 2.7 |
| 完全沉淀pH值 | 6.4 | 9.6 | 3.7 |
(1)碱浸步骤中最好选用a.
a.Na0H溶液b.氨水 c.纯碱溶液
(2)写出滤液1与足量二氧化碳反应的离子方程式AlO2-+CO2+2H2O=Al(OH)3+HCO3-;.
(3)磁选步骤得到的磁性产品为铁.
(4)溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铜离子,二是使使VO2+转化为VO3-.
(5)滤渣3的主要成分为NH4VO3,工业上常用铝热反应法由V205冶炼金属钒,请写出反应的化学方程式3V205+10Al$\frac{\underline{\;高温\;}}{\;}$6V+5Al203.
13.在一定条件下,反应N2+3H2?2NH3,在2L密闭容器中进行,5min内氨的质量增加了0.1mol,则反应速率为( )
| A. | v(H2)=0.03 mol/(L•min) | B. | v(N2)=0.02 mol/(L•min) | ||
| C. | v(NH3)=0.17 mol/(L•min) | D. | v(NH3)=0.01 mol/(L•min) |