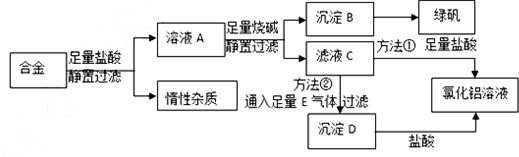
题目内容
5.下列说法不正确的是( )| A. | 用洁净铂丝蘸取未知溶液进行焰色反应,呈黄色火焰,则该溶液有Na+,但不能确定K+的存在 | |
| B. | 实验室制取乙酸乙酯时,向试管中加入乙醇,然后边摇动试管边慢慢加入浓硫酸和冰醋酸 | |
| C. | 用已知浓度NaOH溶液滴定未知浓度盐酸,滴定终点时,俯视刻度线,则测得盐酸浓度偏小 | |
| D. | 相同温度下,可以通过观察气泡多少来比较不同浓度Na2SO3溶液与稀H2SO4溶液反应的快慢 |
分析 A.钠元素的黄色火焰可以覆盖钾元素的紫色火焰;
B.先加入乙醇,再加入浓硫酸;
C.俯视滴定管的刻度,造成标准溶液V(碱)偏小;
D.浓度不同反应速率不同,亚硫酸钠和硫酸反应生成二氧化硫气体,生成气体快慢和混合后溶液体积多少有关.
解答 解:A.钠元素的黄色火焰可以覆盖钾元素的紫色火焰,用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液中有Na+,需要隔着钴玻璃才能观察钾的焰色反应,可能有K+,也可能无钾离子存在,故A正确;
B.先加入乙醇,再加浓硫酸,防止浓硫酸溶解放热造成液体飞溅,最后慢慢加入冰醋酸,故B正确;
C.滴定终点读数时,俯视滴定管的刻度,造成V(碱)偏小,可知c(酸)偏小,故C正确;
D.当溶液体积相同,反应生成气体速率,通过观察单位时间內产生的气泡数来比较反应的快慢,故D错误;
故选D.
点评 本题考查物质的制备、反应速率、中和滴定以及焰色反应等知识,为高考常见题型,侧重于学生的分析能力和实验能力的考查,主要把握实验的严密性和可行性的评价,题目难度中等.

练习册系列答案
相关题目
15.为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如图1:

部分含钒物质在水中的溶解性如表:
回答下列问题:
(1)工业由V2O5冶炼金属钒常用铝热剂法,该反应的氧化剂为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3;
(2)滤液中含钒的主要成分为VOSO4(填化学式).
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据图2判断最佳控制氯化铵系数和温度为4、80℃.
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,反应方程式为:2VO2++H2C2O4+2H+═2VOn++2CO2↑+mH2O,其中n、m分别为2、2.

部分含钒物质在水中的溶解性如表:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)工业由V2O5冶炼金属钒常用铝热剂法,该反应的氧化剂为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3;
(2)滤液中含钒的主要成分为VOSO4(填化学式).
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据图2判断最佳控制氯化铵系数和温度为4、80℃.
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,反应方程式为:2VO2++H2C2O4+2H+═2VOn++2CO2↑+mH2O,其中n、m分别为2、2.
16.用括号内试剂除去下列各物质中少量杂质,其中不正确的是( )
| A. | 苯中己烯(溴水) | B. | 乙酸乙酯中乙酸(饱和Na2CO3溶液) | ||
| C. | 甲烷中乙烯(溴水) | D. | 苯中苯酚(NaOH溶液) |
20.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 25℃时,1L pH=12的Ba(OH)2溶液中含有的OH-的数目为0.02NA | |
| B. | 标准状况下,11.2 L乙醇所含的羟基数为0.5NA | |
| C. | 1 mol Fe与1 mol Cl2反应转移电子数一定为3NA | |
| D. | 常温常压下,19g H3O+含有10NA个电子 |
10.实验室需配制一种仅含五种离子(水电离出的离子可忽略)的混合溶液,且在混合溶液中五种离子的物质的量浓度均为1mol/L.,下面四个选项中能达到此目的是( )
| A. | Al3+、K+、SO42-、Cl-、Al[(OH)4]- | B. | Al3+、Na+、Cl-、SO42-、NO3- | ||
| C. | Na+、K+、SO42-、NO3-、Cl- | D. | Fe2+、H+、Br-、NO3-、Cl- |
14.下列说法正确的是( )
| A. | 离子晶体中只含有离子键,不含有共价键 | |
| B. | 水分子很稳定,因为水分子间存在氢键 | |
| C. | 分子晶体中一定存在分子间作用力,不一定存在共价键 | |
| D. | I的原子半径大于Br,HI比HBr的热稳定性强 |
8.下列物质在常温下发生水解时,对应的离子方程式正确的是( )
| A. | Na2CO3溶液:CO32-+2H2O?H2CO3+2OH- | |
| B. | NH4Cl溶液:NH4++H2O?NH3•H2O+H+ | |
| C. | CuSO4溶液:Cu2++2H2O?Cu(OH)2↓+2H+ | |
| D. | NaClO溶液:ClO-+H2O═HClO+OH- |
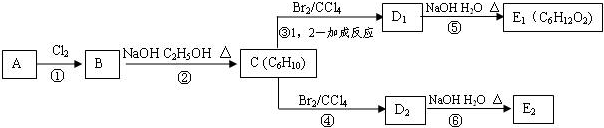
 ;E2含有的含氧官能团的名称为:羟基.
;E2含有的含氧官能团的名称为:羟基.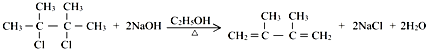 ,反应类型为:消去反应;反应⑥的化学方程式为:
,反应类型为:消去反应;反应⑥的化学方程式为: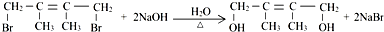 ,反应类型为:水解反应(或取代反应).
,反应类型为:水解反应(或取代反应).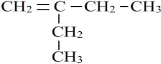 、
、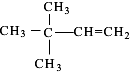 (均不考虑立体异构).
(均不考虑立体异构).