题目内容
5.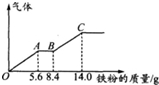 -定浓度H2SO4、HNO3混合后的稀溶液100mL,向其中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示,假设且每一段只对应一个反应,则OA段产生的气体和H2SO4的物质的量浓度分别为( )
-定浓度H2SO4、HNO3混合后的稀溶液100mL,向其中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示,假设且每一段只对应一个反应,则OA段产生的气体和H2SO4的物质的量浓度分别为( )| A. | NO,1.5mol/L | B. | H2,1.5mol/L | C. | NO,2.5mol/L | D. | H2,2.5mol/L |
分析 由图象可知,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,根据OA段消耗铁的质量可计算出生成NO的物质的量;应用BC段生成氢气,则硝酸根离子完全转化成NO,C点溶质为硫酸亚铁,则根据硫酸根离子守恒可计算出原硫酸的物质的量,再根据c=$\frac{n}{V}$计算出硫酸的浓度.
解答 解:由图象可知,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,
OA段总共消耗了5.6gFe,消耗Fe的我质量的为:$\frac{5.6g}{56g/mol}$=0.1mol,根据反应Fe+NO3-+4H+=Fe3++NO↑+2H2O可知0.1mol铁完全反应生成NO的物质的量为0.1mol,
从O点至反应结束总消耗Fe的质量为14.0g,消耗Fe的总物质的量为:$\frac{14.0g}{56g/mol}$=0.25mol,由于反应生成氢气,则OA段说明氢离子过量,硝酸根离子完全反应,C点时溶质为FeSO4,则原硫酸溶液中含有硫酸的物质的量为0.25mol,浓度为$\frac{0.25mol}{0.1L}$=2.5mol/L,
故选C.
点评 本题考查了混合物反应的计算,题目难度中等,明确图象曲线对应反应原理为解答关键,注意掌握守恒思想的应用,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
15.下列各组物质相互混合反应,既有气体生成最终又有沉淀生成的组合完全正确的是( )
①Ba(HCO3)2与稀H2SO4混合
②金属钠投入到FeCl3溶液中
③Na2O2投入到 Ba(NO3)2溶液混合
④Na2O2固体投入到CuSO4溶液.
①Ba(HCO3)2与稀H2SO4混合
②金属钠投入到FeCl3溶液中
③Na2O2投入到 Ba(NO3)2溶液混合
④Na2O2固体投入到CuSO4溶液.
| A. | ①②④ | B. | ③ | C. | ①② | D. | ①②③④ |
16.下列叙述正确的是(NA为阿伏加德罗常数的值)( )
| A. | 1 mol Na2SiO3中含有NA个Na2O | |
| B. | 在H2O2+Cl2═2HCl+O2反应中,每生成32 g氧气,则转移NA个电子 | |
| C. | 标准状况下,分子数为NA的CO、C2H4混合气体体积约22.4 L,质量为28 g | |
| D. | 4.6 g Na与适量氧气完全反应生成Na2O、Na2O2,反应中转移的电子数为0.1NA |
20.NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 1.0L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| C. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 NA | |
| D. | 在反应KI03+6HI=KI+3I2+3H20中,每生成3 mol I2转移的电子数为6 NA |
10.在6HCl+KClO3═3Cl2↑+KCl+3H2O中,被氧化的氯元素与被还原的氯元素的质量比为( )
| A. | 6:1 | B. | 5:1 | C. | 1:5 | D. | 3:1 |
15.下列说法正确的是( )
| A. | 一定温度下,反应 MgCl2(l)═Mg(l)+Cl2(g)的△H>0、△S>0 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 在H2S溶液中,C(H+)和C(S2-)的比值为2:1 | |
| D. | 1 mol/L和0.1 mol/L的两瓶氨水中c(OH-)之比为10:1 |
 如图转化关系中,A、B、C为单质,其余方框内均为化合物,B、X、N常温下为气体,C为黑色固体,D为白色沉淀,A、Y、Z、M、D中均含同一种元素(框图中某些生成物已略去).请填写下列空白:
如图转化关系中,A、B、C为单质,其余方框内均为化合物,B、X、N常温下为气体,C为黑色固体,D为白色沉淀,A、Y、Z、M、D中均含同一种元素(框图中某些生成物已略去).请填写下列空白: