题目内容
16.下列叙述正确的是(NA为阿伏加德罗常数的值)( )| A. | 1 mol Na2SiO3中含有NA个Na2O | |
| B. | 在H2O2+Cl2═2HCl+O2反应中,每生成32 g氧气,则转移NA个电子 | |
| C. | 标准状况下,分子数为NA的CO、C2H4混合气体体积约22.4 L,质量为28 g | |
| D. | 4.6 g Na与适量氧气完全反应生成Na2O、Na2O2,反应中转移的电子数为0.1NA |
分析 A、Na2SiO3是由2个钠离子和1个硅酸根构成;
B、H2O2+Cl2═2HCl+O2反应转移2mol电子,生成1mol氧气;
C、标况下气体摩尔体积为22.4L/mol,且CO和乙烯的摩尔质量均为28g/mol;
D、求出钠的物质的量,然后根据钠反应后变为+1价来分析.
解答 解:A、Na2SiO3是由2个钠离子和1个硅酸根构成,故1molNa2SiO3中含2mol钠离子和1mol硅酸根,不含Na2O,故A错误;
B、H2O2+Cl2═2HCl+O2反应转移2mol电子,生成1mol氧气,故当生成32g氧气即1mol氧气时,转移2mol电子即2NA个,故B错误;
C、标况下气体摩尔体积为22.4L/mol,且CO和乙烯的摩尔质量均为28g/mol,故标准状况下,分子数为NA的CO、C2H4混合气体体积约22.4 L,质量为28g,故C正确;
D、4.6g钠的物质的量为n=$\frac{4.6g}{23g/mol}$=0.2mol,而钠反应后变为+1价,故0.2mol钠转移0.2NA个电子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
7.下列各组离子能大量共存的是( )
| A. | H+、Na+、HCO3-、Cl- | B. | Fe3+、SCN-、Cl-、NO3- | ||
| C. | Mg2+、Cu2+、SO42-、NO3- | D. | Fe2+、SO42-、H+、NO3- |
4.化学与生产、生活密切相关.下列说法不正确的是( )
| A. | 食盐可作调味剂,也可用作食品防腐剂 | |
| B. | 二氧化硫可用于制作葡萄酒的食品添加剂 | |
| C. | 还原铁粉和生石灰均可用作食品包装袋内的脱氧剂 | |
| D. | “地沟油”禁止食用,但可用来制取肥皂 |
1.在恒容密闭容器中,NH3和NO在一定条件下发生如下反应:2NH3(g)+NO(g)?2N2(g)+3H2O(g)△H<0 下列有关说法正确的是( )
| A. | 其它条件不变时,使用高效催化剂,不可以使NO的转化率增大 | |
| B. | 平衡时,其它条件不变,充入NH3,平衡向右移动,NH3的转化率增大 | |
| C. | 当混合气体的密度不变了,则反应达到化学平衡状态 | |
| D. | 平衡时,其它条件不变,升高温度可使该反应的平衡常数增大 |
8.某温度下将Cl2通入KOH溶液里,反应后得到KCI、KC1O、KC1O3的混合溶液,经测定ClO- 与ClO3-的物质的量浓度之比为11:1,则C12与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
| A. | 1:3 | B. | 4:3 | C. | 2:1 | D. | 3:4 |
5.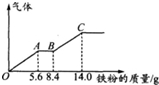 -定浓度H2SO4、HNO3混合后的稀溶液100mL,向其中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示,假设且每一段只对应一个反应,则OA段产生的气体和H2SO4的物质的量浓度分别为( )
-定浓度H2SO4、HNO3混合后的稀溶液100mL,向其中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示,假设且每一段只对应一个反应,则OA段产生的气体和H2SO4的物质的量浓度分别为( )
 -定浓度H2SO4、HNO3混合后的稀溶液100mL,向其中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示,假设且每一段只对应一个反应,则OA段产生的气体和H2SO4的物质的量浓度分别为( )
-定浓度H2SO4、HNO3混合后的稀溶液100mL,向其中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示,假设且每一段只对应一个反应,则OA段产生的气体和H2SO4的物质的量浓度分别为( )| A. | NO,1.5mol/L | B. | H2,1.5mol/L | C. | NO,2.5mol/L | D. | H2,2.5mol/L |