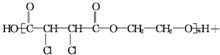题目内容
20.NA为阿伏伽德罗常数的值.下列叙述正确的是( )| A. | 1.0L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| C. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 NA | |
| D. | 在反应KI03+6HI=KI+3I2+3H20中,每生成3 mol I2转移的电子数为6 NA |
分析 A、在偏铝酸钠溶液中,除了偏铝酸钠外,水也含氧原子;
B、求出石墨烯的物质的量,然后根据1mol石墨烯能形成0.5mol六元环来分析;
C、溶液体积不明确;
D、反应KI03+6HI=KI+3I2+3H20转移5mol电子,生成3mol碘单质.
解答 解:A、在偏铝酸钠溶液中,除了偏铝酸钠外,水也含氧原子,故溶液中含有的氧原子的个数大于2NA个,故A错误;
B、12g石墨烯的物质的量为n=$\frac{12g}{12g/mol}$=1mol,而1mol石墨烯能形成0.5mol六元环,即能形成0.5NA个,故B正确;
C、溶液体积不明确,故溶液中的氢氧根的个数无法计算,故C错误;
D、反应KI03+6HI=KI+3I2+3H20转移5mol电子,生成3mol碘单质,故当生成3mol碘单质时转移5mol电子即5NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案
相关题目
10.下列反应中必须加入还原剂才能进行的是( )
| A. | H2→H2O | B. | Fe2O3→Fe2+ | C. | HCl→FeCl2 | D. | Na→NaOH |
8.某温度下将Cl2通入KOH溶液里,反应后得到KCI、KC1O、KC1O3的混合溶液,经测定ClO- 与ClO3-的物质的量浓度之比为11:1,则C12与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
| A. | 1:3 | B. | 4:3 | C. | 2:1 | D. | 3:4 |
5.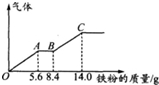 -定浓度H2SO4、HNO3混合后的稀溶液100mL,向其中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示,假设且每一段只对应一个反应,则OA段产生的气体和H2SO4的物质的量浓度分别为( )
-定浓度H2SO4、HNO3混合后的稀溶液100mL,向其中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示,假设且每一段只对应一个反应,则OA段产生的气体和H2SO4的物质的量浓度分别为( )
 -定浓度H2SO4、HNO3混合后的稀溶液100mL,向其中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示,假设且每一段只对应一个反应,则OA段产生的气体和H2SO4的物质的量浓度分别为( )
-定浓度H2SO4、HNO3混合后的稀溶液100mL,向其中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示,假设且每一段只对应一个反应,则OA段产生的气体和H2SO4的物质的量浓度分别为( )| A. | NO,1.5mol/L | B. | H2,1.5mol/L | C. | NO,2.5mol/L | D. | H2,2.5mol/L |
12.0.3mol硫化亚铜跟适量硝酸恰好完全反应.反应方程式为:3Cu2S+22HNO3═6Cu(NO3)2+3H2SO4+10NO+8H2O,则反应中未被还原的硝酸的物质的量为( )
| A. | 2.2mol | B. | 1.2mol | C. | 0.6mol | D. | 1.0mol |
9.设NA代表阿伏加德罗常数,下列说法中正确的是( )
| A. | 100mL1mol/L的碳酸钠溶液中含有CO32-为1NA | |
| B. | 常温、常压下,0.5mol臭氧中含有氧原子为1.5NA | |
| C. | 标准状况下,1mol NO2气体与水反应生成NO3-为NA | |
| D. | 78gNa2O2中含有O2-为2NA |
10.将SO2气体通入BaCl2溶液,若要有白色沉淀产生,不可加入(通入)的试剂是( )
| A. | 硝酸溶液 | B. | 二氧化碳 | C. | 氢氧化钠溶液 | D. | 氨水 |

 +Cl3$\stackrel{一定条件}{→}$
+Cl3$\stackrel{一定条件}{→}$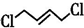
 ;
;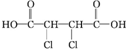 +4NaOH$\stackrel{△}{→}$
+4NaOH$\stackrel{△}{→}$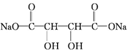 +2NaCl+2H2O;
+2NaCl+2H2O;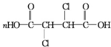 +n
+n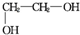 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$