题目内容
10.在6HCl+KClO3═3Cl2↑+KCl+3H2O中,被氧化的氯元素与被还原的氯元素的质量比为( )| A. | 6:1 | B. | 5:1 | C. | 1:5 | D. | 3:1 |
分析 6HCl+KClO3═3Cl2↑+KCl+3H2O中,HCl中Cl元素的化合价升高,被氧化;KClO3中Cl元素的化合价降低,被还原,以此解答该题.
解答 解:6HCl+KClO3═3Cl2↑+KCl+3H2O中,HCl中Cl元素的化合价由-1价升高到0价,被氧化,而KClO3中Cl元素的化合价由+5价降低到0价,被还原,
可知,n(HCl):n(KClO3)=5:1,
被氧化与被还原的都是Cl,其物质的量之比等于质量之比,
则被氧化的氯元素与被还原的氯元素的质量比为5:1,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化是解答本题的关键,注意氧化还原反应中的基本概念,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.在恒容密闭容器中,NH3和NO在一定条件下发生如下反应:2NH3(g)+NO(g)?2N2(g)+3H2O(g)△H<0 下列有关说法正确的是( )
| A. | 其它条件不变时,使用高效催化剂,不可以使NO的转化率增大 | |
| B. | 平衡时,其它条件不变,充入NH3,平衡向右移动,NH3的转化率增大 | |
| C. | 当混合气体的密度不变了,则反应达到化学平衡状态 | |
| D. | 平衡时,其它条件不变,升高温度可使该反应的平衡常数增大 |
18.有五种饱和溶液①Ba(NO3)2 ②Ca(OH)2 ③NaAlO2 ④Na2CO3 ⑤NH3和NaCl,分别持续通入CO2,最终得到沉淀或析出晶体的是( )
| A. | ①②③④⑤ | B. | ①③④⑤ | C. | ③④ | D. | ③④⑤ |
5.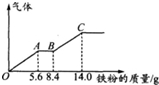 -定浓度H2SO4、HNO3混合后的稀溶液100mL,向其中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示,假设且每一段只对应一个反应,则OA段产生的气体和H2SO4的物质的量浓度分别为( )
-定浓度H2SO4、HNO3混合后的稀溶液100mL,向其中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示,假设且每一段只对应一个反应,则OA段产生的气体和H2SO4的物质的量浓度分别为( )
 -定浓度H2SO4、HNO3混合后的稀溶液100mL,向其中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示,假设且每一段只对应一个反应,则OA段产生的气体和H2SO4的物质的量浓度分别为( )
-定浓度H2SO4、HNO3混合后的稀溶液100mL,向其中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示,假设且每一段只对应一个反应,则OA段产生的气体和H2SO4的物质的量浓度分别为( )| A. | NO,1.5mol/L | B. | H2,1.5mol/L | C. | NO,2.5mol/L | D. | H2,2.5mol/L |
2.下列各组微粒的空间构型相同的是( )
①NH3和H2O
②NH4+和H3O+
③NH3和H3O+
④O3和SO2
⑤CO2和BeCl2
⑥NH4+和SO42-
⑦BF3和Al2Cl6.
①NH3和H2O
②NH4+和H3O+
③NH3和H3O+
④O3和SO2
⑤CO2和BeCl2
⑥NH4+和SO42-
⑦BF3和Al2Cl6.
| A. | 全部 | B. | 除④⑥⑦以外 | C. | ③④⑤⑥ | D. | ②⑤⑥ |
 )在酸性介质中反应制得.写出反应的化学方程式
)在酸性介质中反应制得.写出反应的化学方程式

 )为原料合成一种防碎塑料--聚碳酸酯,简称PC结构简式如图Ⅱ.以PC为原料制成的婴儿奶瓶在使用过程中会析放出极少量的双酚A,长期使用可能损害婴儿的健康.
)为原料合成一种防碎塑料--聚碳酸酯,简称PC结构简式如图Ⅱ.以PC为原料制成的婴儿奶瓶在使用过程中会析放出极少量的双酚A,长期使用可能损害婴儿的健康.
