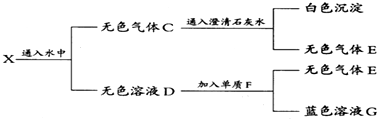
题目内容
15.Na2O、Na2CO3组成的固体混合物8.0g与质量分数为36.5%的盐酸20.0g恰好反应完全(至不再产生气体),蒸干溶液,最终得到的固体质量为( )| A. | 8.0g | B. | 11.7g | C. | 23.4g | D. | 无法计算 |
分析 混合物溶于水,氧化钠溶于水反应生成氢氧化钠,溶液中含有NaOH、Na2CO3,与盐酸恰好反应,所得溶液中溶质为NaCl,蒸干溶液,最终得到固体为NaCl,根据氯离子守恒n(NaCl)=n(HCl),再根据m=nM计算NaCl的质量.
解答 解:混合物溶于水,氧化钠溶于水反应生成氢氧化钠,溶液中含有NaOH、Na2CO3,与盐酸恰好反应,所得溶液中溶质为NaCl,蒸干溶液,最终得到固体为NaCl,根据氯离子守恒n(NaCl)=n(HCl)=$\frac{20.0g×36.5%}{36.5g/mol}$=0.2mol,故m(NaCl)=0.2mol×58.5g/mol=11.7g,故选B.
点评 本题考查混合物的有关计算,难度中等,清楚反应过程是关键,注意根据守恒进行计算,可以简化计算.

练习册系列答案
相关题目
6. 可逆反应mA(g)+nB(g)?pC(g)+qD(g)的v-t图象如图,若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如图.对于下列命题:
可逆反应mA(g)+nB(g)?pC(g)+qD(g)的v-t图象如图,若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如图.对于下列命题:
①a1>a2
②a1<a2
③b1>b2
④b1<b2
⑤t1>t2
⑥t1=t2
⑦两图中阴影部分面积相等
⑧图中阴影部分面积更大.
以上说法中正确的是( )
 可逆反应mA(g)+nB(g)?pC(g)+qD(g)的v-t图象如图,若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如图.对于下列命题:
可逆反应mA(g)+nB(g)?pC(g)+qD(g)的v-t图象如图,若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如图.对于下列命题:①a1>a2
②a1<a2
③b1>b2
④b1<b2
⑤t1>t2
⑥t1=t2
⑦两图中阴影部分面积相等
⑧图中阴影部分面积更大.
以上说法中正确的是( )
| A. | ②④⑤⑦ | B. | ①④⑥⑧ | C. | ②③⑤⑧ | D. | ①③⑥⑦ |
10.在某温度时,将nmol/L的氨水滴入10mL0.1mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )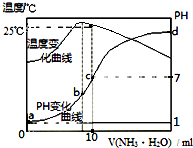

| A. | a点KW=1.0×10-14 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| D. | 25℃时,一水合氨的电离平衡常数为$\frac{1{0}^{-7}}{(10n-1)}$(用n表示) |
20.下列离子方程式中,正确的是( )
| A. | 氯气通入氯化亚铁溶液中:Fe2++Cl2═Fe3++2Cl- | |
| B. | 稀硝酸滴在碳酸钙上:CO32-+2H+═CO2↑+H2O | |
| C. | 铁钉放入硫酸铁溶液中:Fe+Fe3+═2Fe2+ | |
| D. | 稀盐酸滴入硝酸银溶液中;Ag++Cl-═AgCl↓ |
7.设NA为阿伏加德罗常数,则下列叙述正确的是( )
| A. | 0.1mol苯分子中含有0.3NA个碳碳双键 | |
| B. | 1L 1mol/L碳酸钠溶液中阴离子的数目大于NA | |
| C. | 标准状况下,22.4L己烷中含有的分子数共为NA | |
| D. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,转移的电子数目为0.92 NA |
4.不能证明HA是弱酸的是( )
| A. | 0.1 mol•L-1 NaA溶液pH=10 | B. | 0.01 mol•L-1 HA溶液的pH=4 | ||
| C. | pH=2的HA溶液稀释100倍后pH=3.5 | D. | HA溶液跟锌反应,放出H2很慢 |
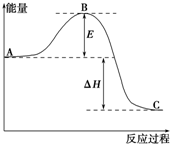 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题: