题目内容
20.下列离子方程式中,正确的是( )| A. | 氯气通入氯化亚铁溶液中:Fe2++Cl2═Fe3++2Cl- | |
| B. | 稀硝酸滴在碳酸钙上:CO32-+2H+═CO2↑+H2O | |
| C. | 铁钉放入硫酸铁溶液中:Fe+Fe3+═2Fe2+ | |
| D. | 稀盐酸滴入硝酸银溶液中;Ag++Cl-═AgCl↓ |
分析 A.电子、电荷不守恒;
B.碳酸钙在离子反应中保留化学式;
C.反应生成硫酸亚铁、电子、电荷不守恒;
D.反应生成AgCl和硝酸.
解答 解:A.氯气通入氯化亚铁溶液中的离子反应为2Fe2++Cl2═2Fe3++2Cl-,故A错误;
B.稀硝酸滴在碳酸钙上的离子反应为CaCO3+2H+═Ca2++CO2↑+H2O,故B错误;
C.铁钉放入硫酸铁溶液中的离子反应为Fe+2Fe3+═3Fe2+,故C错误;
D.稀盐酸滴入硝酸银溶液中的离子反应为Ag++Cl-═AgCl↓,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
10.下列各组有机物,不管它们以何种比例混合,只要总物质的量一定,则完全燃烧时消耗O2为一恒量的是( )
①C2H4和C3H6 ②C5H10和C6H6③C3H6和C3H8O ④C2H2和C6H6 ⑤C2H5OH和CH3OCH3.
①C2H4和C3H6 ②C5H10和C6H6③C3H6和C3H8O ④C2H2和C6H6 ⑤C2H5OH和CH3OCH3.
| A. | ①④ | B. | ②③⑤ | C. | ③⑤ | D. | 全部 |
11.关于实验事故或药品的处理方法中,正确的是( )
| A. | 少量浓硫酸沾在皮肤上,立即用大量氢氧化钠溶液冲洗 | |
| B. | 配制稀硫酸时,可先在量筒中加一定体积的水,再在搅拌下慢慢加入浓硫酸 | |
| C. | 制取蒸馏水时,为了防止瓶内产生暴沸现象,应先向烧瓶内加几片碎瓷片 | |
| D. | 不慎洒出的酒精在桌上着火时,应立即用大量水扑灭 |
8.下列有机物中,含有两种官能团的是( )
| A. | CH3-CH2-Cl | B. | CH3CHO | C. | CH2=CHBr | D. | CH3CH3-OH |
15.Na2O、Na2CO3组成的固体混合物8.0g与质量分数为36.5%的盐酸20.0g恰好反应完全(至不再产生气体),蒸干溶液,最终得到的固体质量为( )
| A. | 8.0g | B. | 11.7g | C. | 23.4g | D. | 无法计算 |
5.N2O俗称“笑气”,曾用作可吸入性麻醉剂,下列反应能产生N2O:3CO+2NO2═3CO2+N2O.下列关于N2O的说法一定正确的是( )
| A. | 等物质的量的N2O和CO2含有相等的电子数 | |
| B. | N2O只有氧化性,无还原性 | |
| C. | 上述反应,每生成l mol N2O,消耗1.5 mol CO | |
| D. | N2O会迅速与人体血红蛋白结合,使人中毒 |
12.室温下,下列有关两种溶液的说法不正确的是( )
| 序号 | ① | ② |
| pH | 12 | 12 |
| 溶液 | 氨水 | 氢氧化钠溶液 |
| A. | 与AlCl3溶液发生反应的离子方程式均为Al3++3OH-=Al(OH)3↓ | |
| B. | ①溶液的物质的量浓度为0.01mol•L-1 | |
| C. | ①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>② | |
| D. | 等体积的①②两溶液分别与0.01mol•L-1的盐酸完全中和,消耗盐酸的体积:①>② |
10.下列有关试剂的保存方法,不正确的是( )
| A. | 浓硝酸保存在棕色试剂瓶中 | B. | 少量金属钠可保存在煤油里 | ||
| C. | 新制氯水保存在棕色试剂瓶中 | D. | 浓硫酸保存在橡胶塞试剂瓶中 |

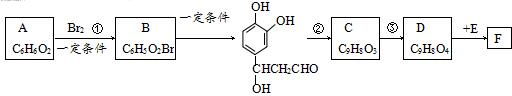
 ;D
;D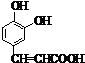 .
.
 +nH2O.
+nH2O.