题目内容
7.设NA为阿伏加德罗常数,则下列叙述正确的是( )| A. | 0.1mol苯分子中含有0.3NA个碳碳双键 | |
| B. | 1L 1mol/L碳酸钠溶液中阴离子的数目大于NA | |
| C. | 标准状况下,22.4L己烷中含有的分子数共为NA | |
| D. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,转移的电子数目为0.92 NA |
分析 A.苯分子中不含有碳碳双键;
B.碳酸根离子水解生成碳酸氢根离子和氢氧根离子;
C.标准状况己烷不是气体;
D.浓硫酸随反应进行,浓度变稀后不和铜反应.
解答 解:A.苯分子中碳碳键是介于单键和双键之间独特的化学键,不含双键,故A错误;
B.碳酸钠在水中发生水解,当生成碳酸氢钠时,每有1mol碳酸氢钠生成同时生成1mol氢氧根,所以溶液中阴离子大于NA,故B正确;
C.标准状况下,22.4 L己烷物质的量不是1mol,故C错误;
D.浓硫酸随反应进行,浓度变稀后不和铜反应,50mL 18.4mol/L浓硫酸与足量铜微热反应,转移的电子的数目小于0.92NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的应用,主要考查气体摩尔体积的条件应用、盐类的水解、浓硫酸与铜的反应,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.Na2O、Na2CO3组成的固体混合物8.0g与质量分数为36.5%的盐酸20.0g恰好反应完全(至不再产生气体),蒸干溶液,最终得到的固体质量为( )
| A. | 8.0g | B. | 11.7g | C. | 23.4g | D. | 无法计算 |
2.将含Mg的两种金属混合物30克与足量稀盐酸反应产生标况下11.2L(标准状况下),则混合物中另一金属可能为( )
| A. | Al | B. | Na | C. | Cu | D. | Fe |
12.室温下,下列有关两种溶液的说法不正确的是( )
| 序号 | ① | ② |
| pH | 12 | 12 |
| 溶液 | 氨水 | 氢氧化钠溶液 |
| A. | 与AlCl3溶液发生反应的离子方程式均为Al3++3OH-=Al(OH)3↓ | |
| B. | ①溶液的物质的量浓度为0.01mol•L-1 | |
| C. | ①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>② | |
| D. | 等体积的①②两溶液分别与0.01mol•L-1的盐酸完全中和,消耗盐酸的体积:①>② |
16.甲、乙两烧杯中分别盛有100mL、1mol•L-1的硫酸溶液和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=5:6,则加入铝粉的质量为( )
| A. | 2.16g | B. | 1.08g | C. | 2.7g | D. | 5.4g |
17.向物质的量浓度为1mol•L-1的KAl(SO4)2溶液中滴入Ba(OH)2溶液,当生成沉淀的质量最大时,铝元素的主要存在形式为( )
| A. | Al3+和Al(OH)3 | B. | Al(OH)3 | C. | AlO2- | D. | AlO2-和Al(OH)3 |
 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.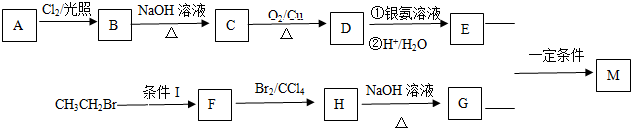
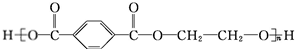 .
. +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$ +2H2O.
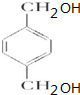
+2H2O.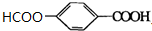 (写出所有可能的结构简式)
(写出所有可能的结构简式)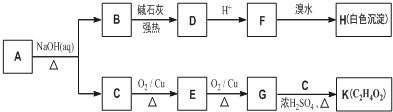
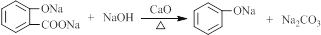 .
.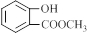 .
.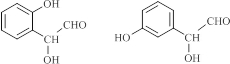 .
.