题目内容
5.0.6mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态B2O3和液态水,放出 800kJ热量,其热化学方程式为:B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-1333.3kJ/mol.分析 0.6mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态B2O3和液态水,放出 800kJ热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出1333.3kJ的热量,根据盖斯定律写出其热化学反应方程式.
解答 解:0.6mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态B2O3和液态水,放出 800kJ热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出$\frac{800}{0.6}$=1333.3kJ的热量,因此其热化学方程式为B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-1333.3kJ/mol,
故答案为:B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-1333.3kJ/mol.
点评 本题考查燃烧热的热化学方程式的书写知识,题目难度不大,注意表示热化学方程式的书写要注明物质聚集状态和反应热的正负号问题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案
相关题目
16.2011年3月11日在日本东太平洋发生里氏9.0级特大地震,福岛一座核电站四个机组发生爆炸,造成具有放射性物质碘-131(原子序数53)等发生泄漏,引发核危机,在我国部分地区还引发抢购碘盐的闹剧.下列有关碘说法正确的是( )
| A. | 131I是一种新发现的元素 | |
| B. | 我们平常食用的加碘盐就是含有碘单质的食盐 | |
| C. | 卤素F、Cl、Br、I中,I的电负性和第一电离能都最小 | |
| D. | 碘单质易升华是由于碘原子半径大,共价键键能小 |
13.下列有关说法正确的是( )
| A. | 若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 | |
| B. | 一定条件下反应N2+3H22?NH3达到平衡时,3v正(H2)=2v逆(NH3) | |
| C. | 酸碱质子理论认为,凡能给出质子(H+) 的物质都是酸,凡能接受质子的物质都是碱.根据这一理论,Al(OH)3、NaHCO3都是两性物质 | |
| D. | 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
20.下列各组物质只用胶头滴管和试管不能鉴别的是( )
| A. | KOH溶液与AlCl3溶液 | B. | NaAlO2溶液与盐酸 | ||
| C. | NaHCO3溶液与盐酸 | D. | Na2CO3溶液与盐酸 |
10.下列各组有机物,不管它们以何种比例混合,只要总物质的量一定,则完全燃烧时消耗O2为一恒量的是( )
①C2H4和C3H6 ②C5H10和C6H6③C3H6和C3H8O ④C2H2和C6H6 ⑤C2H5OH和CH3OCH3.
①C2H4和C3H6 ②C5H10和C6H6③C3H6和C3H8O ④C2H2和C6H6 ⑤C2H5OH和CH3OCH3.
| A. | ①④ | B. | ②③⑤ | C. | ③⑤ | D. | 全部 |
14.250C时,0.1mol•L-1稀醋酸加水稀释,如图中的纵坐标y可以是( )
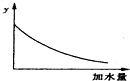

| A. | 溶液的pH | B. | 醋酸的电离平衡常数 | ||
| C. | 溶液的导电能力 | D. | 醋酸的电离程度 |
15.Na2O、Na2CO3组成的固体混合物8.0g与质量分数为36.5%的盐酸20.0g恰好反应完全(至不再产生气体),蒸干溶液,最终得到的固体质量为( )
| A. | 8.0g | B. | 11.7g | C. | 23.4g | D. | 无法计算 |
 二氧化硫(SO2)是中学化学中常见的气体,在生产生活中用途广泛,某化学课题小组对其进行了实验探究,方案如下:
二氧化硫(SO2)是中学化学中常见的气体,在生产生活中用途广泛,某化学课题小组对其进行了实验探究,方案如下: 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.