题目内容
4.不能证明HA是弱酸的是( )| A. | 0.1 mol•L-1 NaA溶液pH=10 | B. | 0.01 mol•L-1 HA溶液的pH=4 | ||
| C. | pH=2的HA溶液稀释100倍后pH=3.5 | D. | HA溶液跟锌反应,放出H2很慢 |
分析 要证明一元酸HA为弱酸,可通过证明以下方法:①证明HA在溶液中不能完全电离、存在电离平衡,②HA对应的强碱盐溶液呈碱性等,以此解答该题.
解答 解:A.0.1 mol•L-1 NaA溶液pH=10,说明NaA为强碱弱酸盐,水解呈碱性,可证明HA为弱酸,故A不选;
B.0.01 mol•L-1 HA溶液的pH=4,说明HA没有完全电离,可证明HA为弱酸,故B不选;
C.常温下,将pH=2的HA溶液稀释100倍,测得pH=3.5,说明加水稀释促进电离,如为强酸,稀释后pH=4,所以可证明为弱酸,故C不选;
D.HA溶液跟锌反应,生成氢气的快慢与溶液的浓度有关,不能根据放出H2很慢,判断为弱酸,如果是强酸浓度很小生成氢气的速率也很小,故D选;
故选D.
点评 本题考查弱电解质的电离平衡及其应用,题目难度中等,侧重于弱酸的实验角度的探究,注意把握实验原理和角度,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
14.250C时,0.1mol•L-1稀醋酸加水稀释,如图中的纵坐标y可以是( )
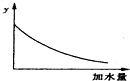

| A. | 溶液的pH | B. | 醋酸的电离平衡常数 | ||
| C. | 溶液的导电能力 | D. | 醋酸的电离程度 |
15.Na2O、Na2CO3组成的固体混合物8.0g与质量分数为36.5%的盐酸20.0g恰好反应完全(至不再产生气体),蒸干溶液,最终得到的固体质量为( )
| A. | 8.0g | B. | 11.7g | C. | 23.4g | D. | 无法计算 |
12.室温下,下列有关两种溶液的说法不正确的是( )
| 序号 | ① | ② |
| pH | 12 | 12 |
| 溶液 | 氨水 | 氢氧化钠溶液 |
| A. | 与AlCl3溶液发生反应的离子方程式均为Al3++3OH-=Al(OH)3↓ | |
| B. | ①溶液的物质的量浓度为0.01mol•L-1 | |
| C. | ①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>② | |
| D. | 等体积的①②两溶液分别与0.01mol•L-1的盐酸完全中和,消耗盐酸的体积:①>② |
16.甲、乙两烧杯中分别盛有100mL、1mol•L-1的硫酸溶液和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=5:6,则加入铝粉的质量为( )
| A. | 2.16g | B. | 1.08g | C. | 2.7g | D. | 5.4g |
13.下列有关平衡常数的说法正确的是( )
| A. | 温度越高,K值越大 | B. | K值越大,正反应速率越大 | ||
| C. | K值的大小与起始浓度有关 | D. | K值越大,反应物的转化率越大 |
 .
. .
.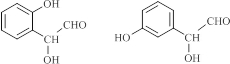 .
.
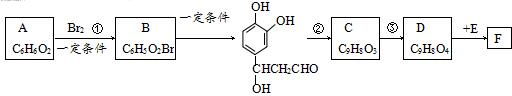
 ;D
;D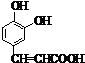 .
.
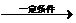
 +nH2O.
+nH2O.