题目内容
6.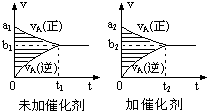 可逆反应mA(g)+nB(g)?pC(g)+qD(g)的v-t图象如图,若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如图.对于下列命题:
可逆反应mA(g)+nB(g)?pC(g)+qD(g)的v-t图象如图,若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如图.对于下列命题:①a1>a2
②a1<a2
③b1>b2
④b1<b2
⑤t1>t2
⑥t1=t2
⑦两图中阴影部分面积相等
⑧图中阴影部分面积更大.
以上说法中正确的是( )
| A. | ②④⑤⑦ | B. | ①④⑥⑧ | C. | ②③⑤⑧ | D. | ①③⑥⑦ |
分析 在反应前加入合适的催化剂,正逆反应速率同等程度的增大,不影响化学平衡移动,则各组分的含量、浓度变化量等均不变,以此来解答.
解答 解:①a1、a2均表示开始反应速率,加催化剂反应速率加快,则a1<a2,故错误;
②由①可知a1<a2,故正确;
③b1、b2均表示平衡时的反应速率,加入合适的催化剂,正逆反应速率同等程度的增大,则平衡速率比原平衡速率大,所以b1<b2,故错误;
④由③可知b1<b2,故正确;
⑤加入催化剂反应速率加快,则达到平衡所需的时间减小,所以t1>t2,故正确;
⑥t1>t2,故错误;
⑦催化剂不影响化学平衡移动,则两图中阴影部分面积(浓度变化量)相等,故正确;
⑧由⑦可知阴影部分面积相等,故错误;
故选A.
点评 本题考查催化剂对反应速率及化学平衡的影响,为高频考点,把握图象中各字母的意义及阴影面积的意义为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.2011年3月11日在日本东太平洋发生里氏9.0级特大地震,福岛一座核电站四个机组发生爆炸,造成具有放射性物质碘-131(原子序数53)等发生泄漏,引发核危机,在我国部分地区还引发抢购碘盐的闹剧.下列有关碘说法正确的是( )
| A. | 131I是一种新发现的元素 | |
| B. | 我们平常食用的加碘盐就是含有碘单质的食盐 | |
| C. | 卤素F、Cl、Br、I中,I的电负性和第一电离能都最小 | |
| D. | 碘单质易升华是由于碘原子半径大,共价键键能小 |
14.250C时,0.1mol•L-1稀醋酸加水稀释,如图中的纵坐标y可以是( )

| A. | 溶液的pH | B. | 醋酸的电离平衡常数 | ||
| C. | 溶液的导电能力 | D. | 醋酸的电离程度 |
1.某澄清透明溶液中只可能含有:Al3+、Mg2+、Fe3+、Fe2+、H+、CO32-、NO3-中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示.则该溶液中一定含有的离子是( )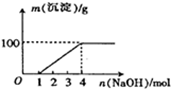

| A. | Mg2+、H+、NO3- | B. | Mg2+、Fe3+、H+、NO3- | ||
| C. | Fe3+、H+、NO3- | D. | Cu2+、H+、NO3- |
11.关于实验事故或药品的处理方法中,正确的是( )
| A. | 少量浓硫酸沾在皮肤上,立即用大量氢氧化钠溶液冲洗 | |
| B. | 配制稀硫酸时,可先在量筒中加一定体积的水,再在搅拌下慢慢加入浓硫酸 | |
| C. | 制取蒸馏水时,为了防止瓶内产生暴沸现象,应先向烧瓶内加几片碎瓷片 | |
| D. | 不慎洒出的酒精在桌上着火时,应立即用大量水扑灭 |
15.Na2O、Na2CO3组成的固体混合物8.0g与质量分数为36.5%的盐酸20.0g恰好反应完全(至不再产生气体),蒸干溶液,最终得到的固体质量为( )
| A. | 8.0g | B. | 11.7g | C. | 23.4g | D. | 无法计算 |
16.甲、乙两烧杯中分别盛有100mL、1mol•L-1的硫酸溶液和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=5:6,则加入铝粉的质量为( )
| A. | 2.16g | B. | 1.08g | C. | 2.7g | D. | 5.4g |
 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.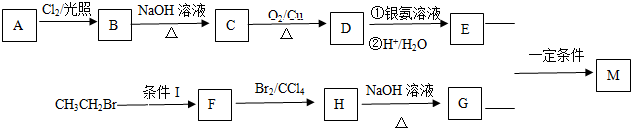
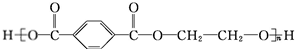 .
.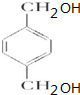 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$ +2H2O.
+2H2O.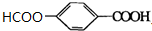 (写出所有可能的结构简式)
(写出所有可能的结构简式)