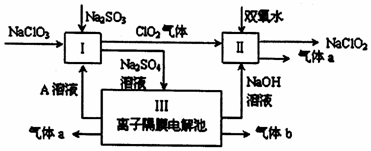
题目内容
13.下列示意图能正确表示H2与Cl2反应生成HCl过程中能量变化的是( )| A. |  | B. |  | ||
| C. |  | D. |  |
分析 H2与Cl2反应生成HCl,放出热量,则反应物总能量大于生成物总能量,且断裂化学键吸收能量,以此来解答.
解答 解:A.图中为吸热反应,与事实不符,故A不选;
B.图中反应物总能量大于生成物总能量,且断裂化学键吸收能量,成键释放能量,反应为放热反应,故B选;
C.与断裂化学键吸收能量,成键释放能量不一致,故C不选;
D.图中为吸热反应,与事实不符,故D不选;
故选B.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、化学键与能量的关系为解答的关键,侧重分析与应用能力的考查,注意图象的分析,题目难度不大.

练习册系列答案
相关题目
3.下列反应属于取代反应的是( )
| A. | H2C=CH2+HCl→H3C-CH2Cl | |
| B. | 2CH3CH2OH+O2$\stackrel{催化剂}{→}$2CH3CHO+2H2O | |
| C. | 2C6H6+15O2 $\stackrel{点燃}{→}$12CO2+6H2O | |
| D. | CH3CH3+Cl2→CH3CH2Cl+HCl |
4.下列有机物中含有( )种官能团


| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
1.下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | Si有导电性 | Si可用于制备光导纤维 |
| B | Fe的金属活动性大于Cu | FeCl3溶液可用于回收废旧电路板中的铜 |
| C | Na2O2与水反应能生成碱 | Na2O2属于碱性氧化物 |
| D | 次氯酸光照易分解 | 新制氯水保存在棕色试剂瓶中,放于冷暗处 |
| A. | A | B. | B | C. | C | D. | D |
8.m mo1乙炔跟n mo1氢气在密闭容器中反应,当其达到平衡时,生成p mol乙烯,将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量是( )
| A. | (3m+n)mol | B. | ($\frac{5}{2}$ m+$\frac{n}{2-3P}$)mol | C. | (3m+n+2p)mol | D. | ($\frac{5m}{2}$+$\frac{n}{2}$)mol |
18.若已知反应 NaNO2+HF═HNO2+NaF,7.2×10-4、4.6×10-4分别是上式所涉及的两种酸的电离常数.由此可判断下列叙述中不正确的是( )
| A. | K(HF)=c(F-)?c(H+)/c(HF ) | B. | K(HNO2)=7.2×10-4 | ||
| C. | 酸性强弱为 HF>HNO2 | D. | K(HNO2)<K(HF) |
2.下列说法正确的是( )
| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而增大有效碰撞的次数 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 催化剂不影响反应活化能但能增大单位体积内活化分子的百分数,从而增大反应速率 |
3.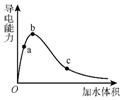 一定温度下,将一定量的纯醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
一定温度下,将一定量的纯醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
 一定温度下,将一定量的纯醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
一定温度下,将一定量的纯醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )| A. | 醋酸的电离度:c<b<a | |
| B. | 溶液的pH值:b<a<c | |
| C. | 蘸取a点溶液滴在湿润的pH试纸上,测得pH值一定偏大 | |
| D. | 若分别取a、b、c三点的溶液各10mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a>b>c |