题目内容
8.m mo1乙炔跟n mo1氢气在密闭容器中反应,当其达到平衡时,生成p mol乙烯,将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量是( )| A. | (3m+n)mol | B. | ($\frac{5}{2}$ m+$\frac{n}{2-3P}$)mol | C. | (3m+n+2p)mol | D. | ($\frac{5m}{2}$+$\frac{n}{2}$)mol |
分析 m mo1乙炔跟n mo1氢气共含2mmolC和(2m+2n)molH,完全燃烧生成CO2和H2O,结合烃燃烧规律来解答.
解答 解:与氢气发生加成反应前后遵循原子守恒,烃燃烧生成二氧化碳和水,由CxHy+(x+$\frac{y}{4}$)$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O,
m mo1乙炔跟n mo1氢气共含2mmolC和(2m+2n)molH,则所需氧气的物质的量是(2m+$\frac{2m+2n}{4}$)mol=($\frac{5m}{2}$+$\frac{n}{2}$)mol,
故选D.
点评 本题考查有机物燃烧反应的计算,为高频考点,把握烃的燃烧规律、原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,22.4 L CCl4含有4NA个Cl原子 | |
| B. | 16gO2和O3组成的混合气体中含有的原子数为NA | |
| C. | 1 mol Na2O2与足量H2O完全反应,转移电子数为2 NA | |
| D. | 78g Na2O2所含的阴离子数为2NA |
19.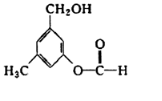 有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )
有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )
①可以使溴水褪色
②可以和NaHCO3溶液反应
③在一定条件下可以和氢气发生反应
④在一定条件下可以发生消去反应
⑤在一定条件下可以发生银镜反应.
 有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )
有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )①可以使溴水褪色
②可以和NaHCO3溶液反应
③在一定条件下可以和氢气发生反应
④在一定条件下可以发生消去反应
⑤在一定条件下可以发生银镜反应.
| A. | ①②③ | B. | ①③⑤ | C. | ①②④ | D. | ③④⑤ |
16.下列有关物质制备的说法中正确的是( )
| A. | 将饱和FeCl3溶液滴入到NaOH溶液中加热煮沸可制得Fe(OH)3胶体 | |
| B. | 可用Na从TiCl4的水溶液中生产Ti | |
| C. | 工业上利用氯气和石灰水反应生产漂白粉和漂粉精 | |
| D. | 可用石英、石灰石、纯碱在高温下生产玻璃 |
3.利用硫酸钾、硫酸镁、硫酸铝三种溶液分别与相同体积、相同浓度的氯化钡溶液反应使Ba2+恰好完全沉淀,需要三种溶液的体积比为3:2:2,则三种溶液的溶质的物质的量浓度之比为( )
| A. | 3:4:2 | B. | 2:3:3 | C. | 6:3:1 | D. | 2:3:1 |
20.(1)碳酸钠溶液中各离子按照浓度从大到小的顺序依次为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
(2)下表是几种常见弱酸的电离平衡常数(25℃)
根据分析表格中数据可知,H2CO3、CH3COOH、HClO 三种酸的酸性从强到弱依次是CH3COOH>H2CO3>HClO;25℃时,等浓度的Na2CO3、NaAc 和NaClO三种溶液的pH从小到大依次是NaAc<NaClO<Na2CO3.
(3)常温下,将0.02mol•L-1 的 Ba(OH)2溶液100mL和0.02mol•L-1的NaHSO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液的 pH 为12.
(4)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11. 该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比,MgF2(填化学式)溶液中的 c(Mg2+)大.
(2)下表是几种常见弱酸的电离平衡常数(25℃)
| 酸 | H2CO3 | CH3COOH | HClO |
| K | K1=4.4×10-7;K 2=4.7×10-11 | K=1.76×10-5 | K=2.95×10-8 |
(3)常温下,将0.02mol•L-1 的 Ba(OH)2溶液100mL和0.02mol•L-1的NaHSO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液的 pH 为12.
(4)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11. 该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比,MgF2(填化学式)溶液中的 c(Mg2+)大.
17.向四支试管中分别加入少量不同溶液进行如下操作,结论正确的是( )
| 操作 | 现象 | 结论 | |
| A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 先滴加2滴KSCN溶液,再滴几滴新制的氯水 | 先不显红色,再滴新制的氯水后溶液变为红色 | 原溶液中有Fe2+ |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
| D | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中 | 溶液变浑浊 | 原溶液中有 CO32- |
| A. | A | B. | B | C. | C | D. | D |
18.下列说法正确的是( )
| A. | 凡是放热反应都是自发的,吸热反应都是非自发的 | |
| B. | 升高温度变化反应速率增大,主要原因是增加了反应物分子中活化分子百分数 | |
| C. | 一个反应的平衡常数越大,则该反应速率也越大 | |
| D. | 化学反应的实质是化学键的断裂和形成,化学反应前后化学键总数不变 |



