题目内容
3.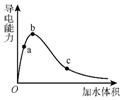 一定温度下,将一定量的纯醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
一定温度下,将一定量的纯醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )| A. | 醋酸的电离度:c<b<a | |
| B. | 溶液的pH值:b<a<c | |
| C. | 蘸取a点溶液滴在湿润的pH试纸上,测得pH值一定偏大 | |
| D. | 若分别取a、b、c三点的溶液各10mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a>b>c |
分析 醋酸为弱电解,浓度越小,电离程度越大,对于该溶液,电离程度反应了氢离子的浓度,溶液导电能力越大,离子浓度越大,结合溶液的电荷守恒分析.
解答 解:A.醋酸为弱电解质,加水促进电离,浓度越小,电离程度越大,则乙酸的电离程度:a<b<c,故A错误;
B.电离程度反应了氢离子的浓度,溶液导电能力越大,离子浓度越大,氢离子浓度越大,pH越小,溶液的pH值:b<a<c,故B正确;
C、由图象可看出,a点稀释导电能力增强,所以开始阶段以溶质的电离为主,则蘸取a点溶液滴在湿润的pH试纸上,测得pH值变小,而不是变大,故C错误;
D、随水的量增加,等体积混合溶液中和碱的能力逐渐降低,所以分别取a、b、c三点的溶液各10 mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a>b>c,故D正确;
故选AC.
点评 本题考查弱电解质的电离,题目难度不大,注意把握弱电解质的电离特点,注意导电能力与离子浓度大小有关.

练习册系列答案
相关题目
14.下列电解质在熔融态(或液态),导电性较强的是( )
| A. | AlCl3 | B. | HCl | C. | NaCl | D. | HAc |
11.把7.8g铝和镁的混合物粉末放入200mL 盐酸中,恰好完全反应并得到标准状况下 8.96LH2,下列说法不正确的为( )
| A. | 该合金中铝的物质的量为 0.2mol | B. | 该合金中镁的物质的量为 2.4g | ||
| C. | 盐酸的物质的量浓度为 4mol/L | D. | 该反应中转移的电子数为0.4NA |
18.下列说法正确的是( )
| A. | 凡是放热反应都是自发的,吸热反应都是非自发的 | |
| B. | 升高温度变化反应速率增大,主要原因是增加了反应物分子中活化分子百分数 | |
| C. | 一个反应的平衡常数越大,则该反应速率也越大 | |
| D. | 化学反应的实质是化学键的断裂和形成,化学反应前后化学键总数不变 |
8.下列离子方程式中正确的是( )
| A. | 少量SO2通入过量氨水中:NH3•H2O+SO2→HSO3-+NH4+ | |
| B. | H2S通入氯水中:S2-+Cl2→S↓+2Cl- | |
| C. | 二氧化氮溶于水:3NO2+H2O→2H++2NO3-+NO | |
| D. | 少量NaHSO4与过量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-→BaSO4↓+2H2O |
5.利用下列试剂,选用合适方法鉴别Na2SO4、Na2SO3、Na2CO3、NaCl四种溶液,最佳试剂组是( )
| A. | BaCl2、HCl、品红溶液 | B. | BaCl2、H2SO4、石蕊溶液 | ||
| C. | AgNO3和HNO3溶液 | D. | AgNO3和BaCl2溶液 |