题目内容
5.亚氯酸钠(NaC1O2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业.它在碱性环境中稳定存在.某同学査阅资料后设计生产NaC1O2的主要流程如图.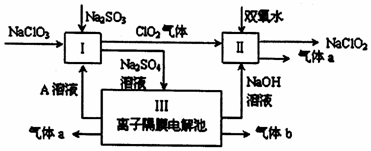
(1)I中发生反应的化学方程式是2NaClO3+Na2SO3+H2SO4=2Na2SO4+2ClO2↑+H2O氧化剂与还原剂的物质的量之比是2:1
(2)II中反应的离子方程式是2ClO2+H2O2+2OH-=2 ClO2-+O2↑+2H2O
(3)装置Ⅲ中阳极的反应是4OH--4e-═O2↑+2H2O
(4)C1O2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O
①该反应中盐酸的作用是起酸的作用
②写出实验室制氯气的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O 说明上述两反应中盐酸作用不同的原因盐酸浓度越大,还原性越强.
分析 由流程可知,硫酸钠溶液通入离子隔膜电解池中,ClO2和双氧水在II中发生氧化还原反应生成NaClO2和气体a,该反应中Cl元素化合价由+4价变为+3价,则O元素化合价由-1价变为0价,所以生成的气体a是O2,离子反应方程式为2ClO2+H2O2+2OH-=2 ClO2-+O2↑+2H2O;
III中发生电解,根据图知,生成氢氧化钠,阴极上生成氢气同时阴极附近生成NaOH,所以生成的气体b是H2;阳极上氢氧根离子放电生成氧气,所以a是O2,同时生成硫酸,所以A溶液是硫酸;酸性条件下,I中NaClO2、Na2SO3发生氧化还原反应,离子反应方程式为2ClO3-+2H++SO32-=2ClO2↑+SO42-+H2O,以此来解答.
解答 解:(1)I中反应方程式为2NaClO3+Na2SO3+H2SO4=2Na2SO4+2ClO2↑+H2O,S元素的化合价升高,则还原剂是Na2SO3,Cl元素的化合价降低,则NaClO3为氧化剂,由反应可知氧化剂与还原剂的物质的量之比是2:1,
故答案为:2NaClO3+Na2SO3+H2SO4=2Na2SO4+2ClO2↑+H2O;2:1;
(2)II中反应的离子方程式是2ClO2+H2O2+2OH-=2 ClO2-+O2↑+2H2O,
故答案为:2ClO2+H2O2+2OH-=2 ClO2-+O2↑+2H2O;
(3)装置Ⅲ中实质为电解水,阳极上阴离子失去电子,则阳极的反应是4OH--4e-═O2↑+2H2O,
故答案为:4OH--4e-═O2↑+2H2O;
(4)①反应中+4价Cl化合价升高也降低,HCl转化为NaCl,则起酸的作用,故答案为:起酸的作用;
②实验室制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,该反应中盐酸作还原剂、酸,两反应中盐酸作用不同的原因盐酸浓度越大,还原性越强,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;盐酸浓度越大,还原性越强.
点评 本题考查制备实验,为高频考点,把握物质的制备流程中发生的反应、实验技能为解答的关键,侧重分析与实验能力的考查,注意氧化还原反应的应用,题目难度不大.

| A. | SiO2是制造光导纤维的材料 | B. | Fe3O4常用于红色油漆和涂料 | ||
| C. | Na2SiO3常用作制木材防火剂 | D. | NaHCO3常用作面粉发泡剂 |
| A. | 将饱和FeCl3溶液滴入到NaOH溶液中加热煮沸可制得Fe(OH)3胶体 | |
| B. | 可用Na从TiCl4的水溶液中生产Ti | |
| C. | 工业上利用氯气和石灰水反应生产漂白粉和漂粉精 | |
| D. | 可用石英、石灰石、纯碱在高温下生产玻璃 |
(2)下表是几种常见弱酸的电离平衡常数(25℃)
| 酸 | H2CO3 | CH3COOH | HClO |
| K | K1=4.4×10-7;K 2=4.7×10-11 | K=1.76×10-5 | K=2.95×10-8 |
(3)常温下,将0.02mol•L-1 的 Ba(OH)2溶液100mL和0.02mol•L-1的NaHSO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液的 pH 为12.
(4)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11. 该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比,MgF2(填化学式)溶液中的 c(Mg2+)大.
| A. | 甲烷的燃烧热为 890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30MPa 下,将 0.5mol N2和 1.5molH2置于密闭容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为:N2+3H2(g)$?_{500℃,30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 稀盐酸和 稀氢氧化钠溶液混合,其热化学方程式为:H+(aq)+OH-(aq)=H2O(1)△H=-57.3 kJ•mol-1 | |
| D. | 1molH2完全燃烧放热 142.9kJ,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(1)△H=+285.8 kJ•mol-1 |
| 操作 | 现象 | 结论 | |
| A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 先滴加2滴KSCN溶液,再滴几滴新制的氯水 | 先不显红色,再滴新制的氯水后溶液变为红色 | 原溶液中有Fe2+ |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
| D | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中 | 溶液变浑浊 | 原溶液中有 CO32- |
| A. | A | B. | B | C. | C | D. | D |
| A. | AlCl3 | B. | HCl | C. | NaCl | D. | HAc |



