题目内容
3.下列反应属于取代反应的是( )| A. | H2C=CH2+HCl→H3C-CH2Cl | |
| B. | 2CH3CH2OH+O2$\stackrel{催化剂}{→}$2CH3CHO+2H2O | |
| C. | 2C6H6+15O2 $\stackrel{点燃}{→}$12CO2+6H2O | |
| D. | CH3CH3+Cl2→CH3CH2Cl+HCl |
分析 A.碳碳双键转化为单键;
B.-OH转化为-CHO;
C.为燃烧反应;
D.H被Cl取代.
解答 解:A.H2C=CH2+HCl→H3C-CH2Cl为加成反应,故A不选;
B.2CH3CH2OH+O2$\stackrel{催化剂}{→}$2CH3CHO+2H2O为氧化反应,故B不选;
C.2C6H6+15O2 $\stackrel{点燃}{→}$12CO2+6H2O为氧化反应,故C不选;
D.CH3CH3+Cl2→CH3CH2Cl+HCl为取代反应,故D选;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机反应类型的判断,题目难度不大.

练习册系列答案
相关题目
14.某有机物结构简式如图,下列说法不正确的是( )
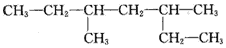
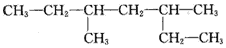
| A. | 该有机物属于烷烃 | |
| B. | 该烃的名称是3,5-二甲基庚烷 | |
| C. | 该烃与2-甲基-3-乙基己烷互为同分异构体 | |
| D. | 它的最简单的同系物二氯代物有两种 |
18.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,22.4 L CCl4含有4NA个Cl原子 | |
| B. | 16gO2和O3组成的混合气体中含有的原子数为NA | |
| C. | 1 mol Na2O2与足量H2O完全反应,转移电子数为2 NA | |
| D. | 78g Na2O2所含的阴离子数为2NA |
15.下列有关物质用途的说法中,不正确的是( )
| A. | SiO2是制造光导纤维的材料 | B. | Fe3O4常用于红色油漆和涂料 | ||
| C. | Na2SiO3常用作制木材防火剂 | D. | NaHCO3常用作面粉发泡剂 |