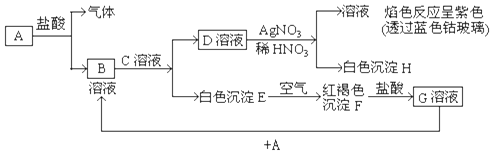
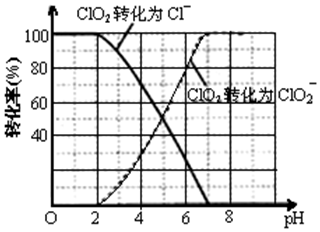
题目内容
2.下列说法正确的是( )| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而增大有效碰撞的次数 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 催化剂不影响反应活化能但能增大单位体积内活化分子的百分数,从而增大反应速率 |
分析 升高温度、加入催化剂可增大活化分子的百分数,而增大压强、增大浓度,可增大单位体积活化分子的数目,但百分数不变,以此解答该题.
解答 解:A.增大反应物浓度,可增大单位体积活化分子的数目,但百分数不变,故A错误;
B.增大压强,可增大单位体积活化分子的数目,但百分数不变,故B错误;
C.升高温度,可使更多的分子转化为活化分子,增加了反应物分子中活化分子的百分数,故C正确;
D.催化剂可降低反应的活化能,故D错误.
故选C.
点评 本题考查化学反应速率的影响因素,为高频考点,侧重于学生的分析能力的考查,注意外界条件对活化分子的影响,难度不大.

练习册系列答案
相关题目
10.下列热化学式中,正确的是( )
| A. | 甲烷的燃烧热为 890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30MPa 下,将 0.5mol N2和 1.5molH2置于密闭容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为:N2+3H2(g)$?_{500℃,30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 稀盐酸和 稀氢氧化钠溶液混合,其热化学方程式为:H+(aq)+OH-(aq)=H2O(1)△H=-57.3 kJ•mol-1 | |
| D. | 1molH2完全燃烧放热 142.9kJ,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(1)△H=+285.8 kJ•mol-1 |
17.向四支试管中分别加入少量不同溶液进行如下操作,结论正确的是( )
| 操作 | 现象 | 结论 | |
| A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 先滴加2滴KSCN溶液,再滴几滴新制的氯水 | 先不显红色,再滴新制的氯水后溶液变为红色 | 原溶液中有Fe2+ |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
| D | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中 | 溶液变浑浊 | 原溶液中有 CO32- |
| A. | A | B. | B | C. | C | D. | D |
7.金属铜是人们最早使用的金属之一,下列关于铜电极的叙述不正确的是( )
| A. | 铜锌原电池中铜是正极 | B. | 用电解法精炼粗铜时粗铜做阳极 | ||
| C. | 在镀件上镀铜时可用金属铜做阳极 | D. | 电解水制H2、O2时铜做阳极 |
14.下列电解质在熔融态(或液态),导电性较强的是( )
| A. | AlCl3 | B. | HCl | C. | NaCl | D. | HAc |
11.把7.8g铝和镁的混合物粉末放入200mL 盐酸中,恰好完全反应并得到标准状况下 8.96LH2,下列说法不正确的为( )
| A. | 该合金中铝的物质的量为 0.2mol | B. | 该合金中镁的物质的量为 2.4g | ||
| C. | 盐酸的物质的量浓度为 4mol/L | D. | 该反应中转移的电子数为0.4NA |