题目内容
7.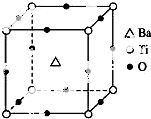 如图所示晶体结构是一种具有优良的压电功能的铁片晶体材料的最小结构单元(晶胞),晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是( )
如图所示晶体结构是一种具有优良的压电功能的铁片晶体材料的最小结构单元(晶胞),晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是( )| A. | 8 BaTi8O12 | B. | 8 BaTi4O9 | C. | 6 BaTiO3 | D. | 3 BaTi2O3 |
分析 根据结构可知,Ba位于体心为1个,Ti位于顶点,为8×$\frac{1}{8}$=1个,O位于棱心,为12×$\frac{1}{4}$=3个,晶体内“Ti”紧邻的氧原子在棱上.
解答 解:由结构可知,Ba位于体心为1个,Ti位于顶点,为8×$\frac{1}{8}$=1个,O位于棱心,为12×$\frac{1}{4}$=3个,其化学式为BaTiO3,晶体内“Ti”紧邻的氧原子在棱上,则晶体内与每个“Ti”紧邻的氧原子数为$\frac{3×8}{4}$=6个,化学式为BaTiO3,故选C.
点评 本题考查了晶胞的计算,利用均摊法来分析解答即可,难点是配位数的判断,难度较大.

练习册系列答案
相关题目
19.NA为阿伏加德罗常数,下列叙述错误的是( )
| A. | 18gNH4+中含有的电子数为11NA | |
| B. | 12g石墨中含有的共价键数为1.5NA | |
| C. | 标准状况下,22.4LNO2和CO2混合物中含有原子总数为3NA | |
| D. | 1 mol Na与足量O2反应,生成 Na2O和Na2O2的混合物,钠失去NA个电子 |
20.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1.8 g 重水(D2O)中含有的中子数为NA | |
| B. | 常温常压下,22.4 L O2 含有的分子数为NA | |
| C. | 1 L 1 mol/L FeCl3溶液中含有Fe3+的数目为NA | |
| D. | 0.1 mol CO2分子中含有的共用电子对的数目是0.4 NA |
17.下列描述的一定是金属元索的是( )
| A. | 原子核内有4个质子的元素 | B. | 能与水反应的单质 | ||
| C. | 原子的最外层只有2个电子的元素 | D. | 能形成离子化合物的元素 |
2.下列说法正确的是( )
| A. | 原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 | |
| B. | Zn2+核外电子排布式为1s22s22p63s23p63d10 | |
| C. | 基态铜原子的外围电子排布图: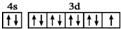 | |
| D. | 基态碳原子的最外层电子排布图: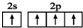 |
12.将0.1mol/L的醋酸钠溶液20ml与0.1mol/L盐酸10mL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是( )
| A. | c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)>c(OH-) | |
| C. | c(CH3 COO-)=c(Cl-)>c(H+)>c(CH3COOH)>c(OH-) | |
| D. | c(Cl-)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
19.下列物质性质的变化规律与分子间作用力有关的是( )
| A. | HF、HCl、HBr、HI热稳定性依次减弱 | |
| B. | NaF、NaCl、NaBr、NaI的熔点依次降低 | |
| C. | 金刚石的硬度大于硅,其熔、沸点也高于硅 | |
| D. | F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
16.将W1g光亮的铜丝在空气中加热一段时间后,迅速插入下列物质中,取出干燥,如此反复几次,最后取出铜丝用蒸馏水洗涤、干燥,称得其质量为W2 g.实验时由于所插入的物质不同,铜丝的前后质量变化可能不同,下列所插物质与铜丝的质量关系正确的是( )
| A. | 石灰水,W1=W2 | B. | 乙醇溶液,W1=W2 | C. | NaHSO4,W1<W2 | D. | CO,W1>W2 |
